
|
|
DERS ÖZETİ, KRİBS
İnorganik kimya. Hile sayfası: kısaca, en önemlisi
Rehber / Ders notları, kopya kağıtları içindekiler
1. Vücuttaki metabolizma ve enerji süreçleri arasındaki ilişki. termodinamik sistem Dünyadaki yaşam süreçleri büyük ölçüde güneş enerjisinin biyojenik maddelerde (proteinler, yağlar, karbonhidratlar) birikmesinden ve bu maddelerin daha sonra enerji salınımı ile canlı organizmalarda dönüşümlerinden kaynaklanmaktadır. A. M. Lavoisier (1743-1794) ve P. S. Laplace (1749-1827)'nin çalışmaları, yaşam boyunca salınan enerjinin, gıda ürünlerinin hayvanlar tarafından solunan havadaki oksijen tarafından oksidasyonu tarafından belirlendiğini doğrudan kalorimetrik ölçümlerle gösterdi. XIX-XX yüzyıllardaki gelişme ile. termodinamik, biyokimyasal reaksiyonlarda enerjinin dönüşümünü nicel olarak hesaplamak ve yönlerini tahmin etmek mümkün oldu. Termodinamik yöntem bir dizi katı konsepte dayanmaktadır: "sistem", "sistemin durumu", "sistemin iç enerjisi", "sistem durumunun işlevi". termodinamik sistem Yeterince fazla sayıda molekülden (yapısal birimler) oluşan ve doğanın diğer nesnelerinden gerçek veya hayali bir sınır yüzeyi (arayüz) ile ayrılan herhangi bir doğa nesnesine denir. Sistemde yer almayan doğa nesnelerine çevre denir. Sistemlerin en yaygın özellikleri m - sistemde bulunan maddenin kütlesi ve E - sistemin iç enerjisidir. Sistemin maddesinin kütlesi, onu oluşturan moleküllerin toplam kütlesi ile belirlenir. Sistemin iç enerjisi, moleküllerin termal hareketinin enerjileri ile aralarındaki etkileşim enerjisinin toplamıdır. Çevre ile madde ve enerji alışverişinin doğasına göre sistemler izole, kapalı ve açık olmak üzere üç tipe ayrılır. yalıtılmış sistem ortamla madde veya enerji alışverişi yapmayan sisteme denir (Δm = 0, ΔE = 0). Kapalı bir sistem, çevre ile madde alışverişi yapmayan, ancak enerji alışverişi yapabilen bir sistemdir (Δm = 0, ΔE^ 0). Enerji alışverişi ısı transferi veya iş yaparak gerçekleştirilebilir. sistemi aç ortamla hem madde hem de enerji alışverişi yapabilen böyle bir sisteme denir (Δm ≠ 0, ΔE ≠ 0). Açık sistemin önemli bir örneği canlı hücredir. Sistemler, oluşturdukları maddenin kümelenme durumuna göre homojen ve heterojen olarak ikiye ayrılır. Homojen bir sistemde, sistemin bir alanından diğerine geçerken fiziksel ve kimyasal özelliklerde keskin bir değişiklik olmaz. Böyle bir sistemin bir örneği, çeşitli biyojenik maddelerin bir çözeltisi olan kan plazmasıdır. Heterojen bir sistem iki veya daha fazla homojen parçadan oluşur. Heterojen bir sistemin bir örneği, tam kan, yani hücreli plazma - eritrositler ve lökositlerdir. 2. Termodinamiğin birinci yasası. Sistemi karakterize eden kavramlar Termodinamiğin birinci yasası, çeşitli sistemlerin enerjisini analiz etmek için titiz bir nicel çerçeve sağlar. Bunu formüle etmek için, sistemi karakterize eden bir dizi yeni kavramı tanıtmak gerekir. En önemli kavramlardan biri sistemin durumudur. Durum, termodinamik bakış açısından bir sistemi tanımlamayı mümkün kılan bir dizi sistem özelliği olarak anlaşılır. Sistemin durumunun genelleştirilmiş bir özelliği olarak şu kavramlar kullanılır: "denge", "durağan", "geçiş durumu". Tüm özellikler herhangi bir uzun süre sabit kalırsa ve sistemde madde ve enerji akışı yoksa sistemin durumuna denge denir. Sistemin özellikleri zaman içinde sabitse, ancak madde ve enerji akışları varsa, duruma durağan denir. Nicel olarak, durumlar termodinamik değişkenler yardımıyla ayırt edilir. Termodinamik değişkenler, bir bütün olarak sistemin durumunu karakterize eden niceliklerdir. Ayrıca sistemin termodinamik parametreleri olarak da adlandırılırlar. En önemli termodinamik değişkenler basınç p, sıcaklık T, sistemin hacmi V veya sistemin toplam kütlesi m, sistemi oluşturan kimyasalların (bileşenlerin) kütleleri mk veya bu maddelerin konsantrasyonu m'dir. Bir doktor tarafından hastanın durumunu belirlemek için benzer özelliklerin (sıcaklık, ağırlık, biyolojik sıvıların bileşimi, kan basıncı) kullanıldığına dikkat edilmelidir. Bir sistemin bir durumdan başka bir duruma geçişine denir. süreç. İşlem sonucunda sistemin durumu ve termodinamik değişkenler değişir. Termodinamik değişkenin başlangıç durumundaki değerini X olarak gösterirsek1 ve son olarak - X2 , o zaman bu değişkendeki değişiklik sırasıyla ΔX = X'e eşittir2 - X1 ve termodinamik değişken X'in artışı olarak adlandırılır. Zıt işaretle alınan artış, X değişkenindeki azalma olarak adlandırılır. E sisteminin iç enerjisi, termodinamik durum fonksiyonlarından biridir. Durum işlevlerinin önemli bir özelliği, sistemin belirli bir durumuna ulaşma yönteminden bağımsız olmalarıdır. Sistemin ΔE iç enerjisindeki değişim, sistemin çevre ile etkileşimi sırasında gerçekleştirilen W işinden ve çevre ile sistem arasındaki ısı Q alışverişinden kaynaklanmaktadır, bu miktarlar arasındaki oran termodinamiğin birinci yasasının içeriği. Bazı işlemlerde sistemin iç enerjisindeki artış ΔE, sistem tarafından alınan ısı Q'ya ve bu işlemde sistem üzerinde yapılan W işe eşittir.: ∆E=Q+W. Biyolojik sistemlerde ısı genellikle sistem tarafından dış ortama verilir ve iç enerji kaybı nedeniyle sistem tarafından iş yapılır. Termodinamiğin birinci yasasının matematiksel kaydını şu şekilde temsil etmek uygundur: ∆E = Q - W. Yukarıdaki formüllerdeki tüm miktarlar joule (J) cinsinden ölçülür. 3. Termodinamiğin birinci yasası Termodinamiğin birinci yasası, başka hiçbir yasadan türetilemeyen temel doğa yasalarından biridir. Geçerliliği sayısız deneyle, özellikle, birinci tür bir sürekli hareket makinesi, yani dışarıdan enerji sağlamadan keyfi olarak uzun süre çalışabilen böyle bir makine inşa etmeye yönelik başarısız girişimlerle kanıtlanmıştır. Sistemdeki sürecin koşullarına bağlı olarak, termodinamiğin birinci yasasından türetilen çeşitli durum fonksiyonları kullanılır. Aynı zamanda, kütle ve enerjinin dönüşümleri hakkında sonuçlar elde etmek için karmaşık biyolojik sistemler yerine basitleştirilmiş modeller kullanılır. Sistemdeki basınç sabit tutulur, dış basınca eşittir. p = const'ta meydana gelen bu tür işlemlere izobarik denir. Bir izobarik süreçte yapılan genişleme işinin şu şekilde olduğu bilinmektedir: W = ρΔV, burada ΔV sistemin hacim artışıdır, durum 2 ve 1'deki hacimler arasındaki farka eşittir. Genişletme işini birinci yasanın matematiksel ifadesi ile değiştirerek ve basit dönüşümler yaparak şunları elde ederiz: Qρ = ΔE + pΔV = (E2 + ρV2)-(E1 +ρΔV1) burada Qρ, izobarik sürecin ısısıdır; 1, 2 - sürecin başlangıcı ve sonu ile ilgili dizinler. (E + pV) değeri, H ile gösterilen ve entalpi olarak adlandırılan sistemin durumunun bir fonksiyonudur: H = E + ρV. Buna göre ifade şu şekilde yazılabilir: Qp = H2 - H1 = ∆H. Bu ifadeden şu sonuç çıkar entalpi - artışı, izobarik süreçte sistem tarafından alınan ısıya eşit olan durum fonksiyonu. Belirli bir süreçteki entalpi artışının ölçümü, bu işlemin bir kalorimetrede sabit basınçta yapılmasıyla gerçekleştirilebilir. A. M. Lavoisier ve P. S. Laplace, canlı bir organizmada metabolizmanın enerjisini inceleyerek deneylerini tam olarak böyle gerçekleştirdi. Sistemin durumundaki değişikliğin sabit bir hacimde meydana geldiği durumlarda, sürece izokorik denir. Bu durumda, AV hacmindeki değişiklik sıfıra eşittir ve formüle göre, genişleme çalışması W = 0. Ardından termodinamiğin birinci yasasının matematiksel ifadesinden şu çıkar: Qv = ∆E. Termodinamik tanım yukarıdaki bağıntıdan gelir: içsel enerji - artışı, izokorik süreçte sistem tarafından elde edilen ısı QV'ye eşit olan durum fonksiyonu. Bu nedenle, belirli bir süreçte iç enerjideki değişim, bu işlem sabit hacimde bir kalorimetre içinde gerçekleştirilerek ölçülebilir. Buradan ρ = const'ta iç enerji ve entalpi artışlarının ilişki ile ilişkili olduğu sonucu çıkar: ∆H = ∆E + ρ∆V. 4. Hess yasası Termodinamiğin kimyasal reaksiyonlarda enerji dönüşümünü inceleyen bölümüne kimyasal termodinamik denir. Bu reaksiyona karşılık gelen iç enerji ΔE, entalpi ΔH veya başka bir durum fonksiyonundaki değişikliklerin gösterildiği reaksiyon denklemine termokimyasal denir. Sistemin entalpisinin azaldığı (ΔH < 0) ve ısının dış ortama salındığı kimyasal reaksiyonlara denir. ekzotermik. Entalpinin arttığı (ΔH > 0) ve sistemin ısıyı emdiği reaksiyonlar Qp dışarı denir endotermik. Glikozun oksijenle oksidasyonu, büyük miktarda ısının salınmasıyla gerçekleşir (Qp \u2800d XNUMX kJ / / mol), yani bu işlem ekzotermiktir. Karşılık gelen termokimyasal denklem şu şekilde yazılabilir: С6 Н12 О6 + 602 = 6С02 + 6Н2Oh, ΔH = 2800 kJ. Çözeltide meydana gelen reaksiyonlara genellikle sistemin hacminde küçük bir değişiklik eşlik eder, yani ΔV ≈ 0. Bu bağlamda, birçok durumda biyolojik hesaplamalarda ΔH = ΔE olduğunu varsayabiliriz. Sonuç olarak, bu tür sistemlerde ısı salınımı, esas olarak reaksiyonun sonucu olarak iç enerjideki azalmadan kaynaklanır ve bunun tersi de geçerlidir. A bileşiğinin oluşum entalpisi, ΔH sisteminin entalpisindeki değişimdir.A basit maddelerden 1 mol bileşik A oluşumuna eşlik eder. Oksijen, karbon, hidrojen ve diğer tüm temel (basit) maddelerin oluşum entalpilerinin sıfır olduğu varsayılır. Diğer şeyler eşit olmak üzere, iç enerji ve entalpi sistemdeki madde miktarı ile orantılıdır. Bu tür termodinamik fonksiyonlara kapsamlı denir. Termodinamik açısından, genel formun reaksiyonu nAbir + pВ = nС + nD , Δh sistemin başlangıç durumundan H entalpisi ile geçişidir.1 entalpi H ile durum 2'ye2. Bu reaksiyonun entalpisi olarak adlandırılan bu geçişin bir sonucu olarak sistemin entalpisindeki değişim, farka eşittir: ΔHpya = H2 - H1 = (ncHc + nDHD) - (NАНА + nBHB). Isı toplamlarının sabitliği yasası, 1840 yılında Rus kimyager G. I. Hess tarafından keşfedildi. Termodinamiğin birinci yasasının kimyasal dönüşümlerde uygulanabilirliğini keşfeden ve kimyasal termodinamiğin kurucusudur. Şu anda, Hess yasası termodinamiğin birinci yasasının bir sonucu olarak kabul edilir ve şu şekilde formüle edilir: belirli reaktiflerden sabit basınçta verilen ürünlerin oluşumundaki entalpi artışı, oluşumla sonuçlanan reaksiyonların sayısına ve türüne bağlı değildir. bu ürünlerin. Termokimyasal hesaplamalarda, Hess yasasının kendisi daha sık kullanılmaz, ancak bunun sonucu, eşitlik şeklinde belirli bir glikoz oksidasyonu durumu için yukarıda türetilir (2). Genel form p olarak sunulan bir reaksiyon içinАbir + pвB = = nсC + nDD, Hess yasasının bir sonucu ΔH eşitliği kullanılarak yazılırpya = (nCΔHC + nDΔHD) - (NAΔHA ++nBΔHB ) ve aşağıdaki gibi formüle edilmiştir: tepkime entalpisi, stokiyometrik miktardaki ürünlerin oluşum entalpilerinin cebirsel toplamı ile stokiyometrik miktardaki reaktanların oluşum entalpilerinin cebirsel toplamının çıkarılmasına eşittir. 5. Termodinamiğin ikinci yasası. Gibbs serbest enerjisi Vücut, kendisini oluşturan maddelerin atomlarının kimyasal etkileşim enerjisi şeklinde depolanan iç enerjiyi harcayarak iş yapar. Termodinamiğin birinci yasasının matematiksel ifadesi ΔE \uXNUMXd Q - W, sistemin iç enerjisinin tüketimi ΔЕ, sistem tarafından gerçekleştirilen W işi ve şeklinde kaybolan enerji Q arasındaki kesin ilişkiyi belirler. sıcaklık. Bununla birlikte, termodinamiğin birinci kanunundan, harcanan iç enerjinin işe dönüştürülebilen kısmını belirlemek imkansızdır. Teorik maliyet tahminleri, termodinamiğin ikinci yasasına dayanmaktadır. Bu yasa, enerjiyi işe dönüştürmenin verimliliğine katı kısıtlamalar getirir ve ayrıca, bir sürecin kendiliğinden akışı olasılığı için kriterler getirmenize izin verir. süreç denir doğalherhangi bir etkisi olmadan gerçekleştirilirse, sistem kendi haline bırakıldığında. Sistemin iç enerjisinin değişmediği süreçler vardır (ΔE = 0). Bu tür işlemler, örneğin, su içinde asetik asidin iyonizasyonunu içerir. Bir dizi kendiliğinden süreç, iç enerjide bir artışla (AE > 0) ilerler. Bu, özellikle, albüminin (kan plazma proteini) biyoinorganik bileşiklerinin Cu gibi metal iyonları ile oluşumunun tipik reaksiyonlarını içerir.2+. Kapalı sistemler için iç enerji AE'sindeki değişim, kendiliğinden süreçler için bir kriter olarak hizmet edemez. Sonuç olarak, bu kriterin türetildiği termodinamiğin birinci yasası, süreçlerin verimliliği kadar kendiliğindenlik sorununu çözmek için yeterli değildir. Bu soruların çözümü, termodinamiğin ikinci yasasının yardımıyla elde edilir. Termodinamiğin ikinci yasasını formüle etmek için termodinamik anlamda tersinir ve tersinmez süreç kavramlarını tanıtmak gerekir. Sistem dengedeyse, bu durum aynı dış koşullar altında süresiz olarak korunur. Dış koşullar değiştiğinde sistemin durumu değişebilir, yani sistemde bir süreç gerçekleşebilir. İlk durum 1'den son durum 2'ye geçiş sırasında tüm ara durumlar dengedeyse, bir işlemin termodinamik olarak tersine çevrilebilir olduğu söylenir. Ara durumlardan en az biri dengesiz ise, sürece termodinamik olarak tersinmez denir. Tersine çevrilebilir bir işlem, yalnızca sistem parametrelerinde - sıcaklık, basınç, madde konsantrasyonu vb. - yeterince yavaş bir değişiklikle gerçekleştirilebilir. Parametrelerdeki değişim oranı, işlem sırasında meydana gelen dengeden sapmalar olacak şekilde olmalıdır önemsizdir. Tıpta önemli bir problemin tersine çevrilebilirlik ile ilişkili olduğu unutulmamalıdır - dokuların düşük sıcaklıklarda korunması. Tersinir süreçler, doğada meydana gelen ve endüstride veya laboratuvarlarda gerçekleştirilen gerçek süreçlerin sınırlayıcı durumudur. 6. Termodinamiğin ikinci yasası. Entropi Maksimum çalışma WmaksimumDurum 1'den durum 2'ye geçiş sürecinde belirli bir iç enerji ΔE kaybı ile elde edilebilen , ancak bu süreç tersine çevrilebilirse elde edilir. Termodinamiğin birinci yasasının ifadesine göre, minimum ısı Qdk Qdk \uXNUMXd AE - Wmaksimum . Sistemin iç enerjisinin maliyet verimliliğini karakterize eden maksimum ulaşılabilir verimlilik faktörü sırasıyla şuna eşittir: ηmaksimum=Wmaksimum / ΔE. Durum 1'den durum 2'ye geri dönüşü olmayan bir geçiş sürecinde, sistem tarafından yapılan iş W'den küçüktür. Maksimum faktör h'yi hesaplamak içinmaksimum bilinen bir ΔE değeriyle, W'nin değerini bilmek gerekirmaksimum veya Qdk Wmaksimum = AE - Qdk , bu nedenle, ηmaksimum \u1d XNUMX - ΔE / Qdk . Q değeridk entropi adı verilen bir termodinamik durum fonksiyonu kullanılarak termodinamiğin ikinci yasasından hesaplanabilir. Entropi kavramı (1865) termodinamiğin ve termal süreçlerin moleküler kinetik teorisinin kurucularından biri olan Alman fizikçi R. Yu Clausius (1822-1888) tarafından tanıtıldı. Clausius'a göre entropinin termodinamik tanımı: entropi, ΔS artışı ısı Q'ya eşit olan bir durum fonksiyonudur.dk Sisteme tersinir bir izotermal süreçte getirilen, işlemin gerçekleştirildiği mutlak sıcaklık T bölü: ∆S = Qdk / T. Formülden entropinin biriminin J/K olduğu sonucu çıkar. Tersine çevrilebilir bir izotermal işleme örnek olarak, 273°K sıcaklıkta suyla dolu bir termosta buzun yavaş yavaş erimesi gösterilebilir. 1 mol buzun (18 g) erimesi için en az 6000 J ısı sağlanması gerektiği deneysel olarak kanıtlanmıştır. Bu durumda termostaki "buz - su" sisteminin entropisi ΔS = 6000 J artar: 273°K = 22 J/K. Sulu bir termos 273°K'de soğutulduğunda, 6000 J ısı yavaşça uzaklaştırılabilir ve suyun kristalleşmesi sırasında 1 mol buz oluşur. Bu işlem için Qdk formülde negatiftir. Buna göre, 1 mol buz oluşumu sırasında "buz - su" sisteminin entropisi ΔS = 22 J/K azalır. Benzer şekilde, bu işlemler sırasında sisteme verilen veya sistemden alınan ısı biliniyorsa, herhangi bir izotermal fiziksel ve kimyasal işlem için entropi değişimini hesaplamak mümkündür. Fizikten bilindiği gibi, bu ısı kalorimetrik ölçümler kullanılarak belirlenebilir. Bu nedenle, entropideki ve sistemin durumunun diğer iki işlevindeki - iç enerji ve entalpi - değişiklik deneysel olarak belirlenmiş bir niceliktir. Entropinin fiziksel anlamı ve iç enerji, moleküler kinetik bakış açısıyla izole sistemlerde meydana gelen süreçler göz önüne alındığında açıkça ortaya çıkar. 7. Boltzmann formülü Yalıtılmış sistemler, tanım gereği, çevre ile madde veya enerji alışverişinde bulunmazlar. Tabii ki, bu tür sistemler aslında doğada mevcut değildir. Ancak, sistemi mantarla kapatılmış bir termos içine yerleştirerek çok iyi bir yalıtım elde edilebilir. Herhangi bir kendiliğinden sürecin, ancak entropide bir artış ile karakterize edilirse, yalıtılmış bir sistemde gerçekleşebileceği ortaya çıktı; dengede, sistemin entropisi sabittir: ∆S ≥ 0. Deneysel gözlemlere dayanan bu ifade, termodinamiğin ikinci yasasının olası formülasyonlarından biridir. Termodinamiğin ikinci yasasına göre kendiliğinden olanın tersi olan bir süreç izole bir sistemde ilerleyemez, çünkü böyle bir süreç entropide bir azalma ile karakterize edilir. Çeşitli izole sistemlerin incelenmesi, kendiliğinden süreçlerin her zaman sistemin mikro durumlarının w sayısındaki bir artışla ilişkili olduğunu gösterir. Aynı işlemlerde, sistemin entropisi S artar, yani mikro durum sayısındaki artışla entropi artar. İlk kez, böyle bir bağımlılığın varlığı, 1872'de ilişkiyi öneren Avusturyalı fizikçi L. Boltzmann tarafından fark edildi: КБ =R/NA = 1,38 - 1023 J/K, nerede KБ - Boltzmann sabiti, gaz sabiti R'nin Avogadro sabiti N'ye oranına eşitA . Bu ilişkiye Boltzmann formülü denir. Boltzmann formülü, olası mikro durumların sayısından bir sistemin entropisini teorik olarak hesaplamayı mümkün kılar. Bu tür hesaplamalar, deneysel olarak belirlenen değerlerle iyi bir uyum içindedir. Özellikle, 0°K'de kristalli maddelerin mikro durumlarının sayısının w'ye yakın olduğu bilinmektedir.0 "1. Böylece, sadece göreceli değerlerin belirlenebildiği iç enerji E ve entalpi H'nin aksine, kristalleşen maddelerin entropisinin mutlak değerleri belirlenebilir. Çoğu durumda bir sistemin mikro durumlarının sayısındaki artış, sistemin enerjisinin daha olası dağılımlarına geçişle birlikte bu sistemdeki düzensizliğin artmasıyla ilişkilendirilebilir. Boltzmann ilişkisine dayanarak, entropinin moleküler-kinetik bir tanımı verilebilir. Entropi, bir sistemin belirli bir durumda olma olasılığının bir ölçüsü veya sistem bozukluğunun bir ölçüsüdür. Entropi kavramının önemi, bu değere dayanarak kendiliğinden süreçlerin yönünü tahmin etmenin mümkün olmasından kaynaklanmaktadır. Bununla birlikte, süreçlerin yönü için bir kriter olarak entropi ölçmenin uygulanabilirliği, termodinamiğin ikinci yasasının formülasyonuna uygun olarak yalıtılmış sistemlerle sınırlıdır. 8. Gibbs enerjisi Açık ve kapalı sistemlerde süreçlerin kendiliğindenliği için bir kriter olarak yeni bir durum fonksiyonu olan Gibbs enerjisi tanıtıldı. Bu fonksiyon adını, bu fonksiyonu türeten ve daha sonra termodinamik çalışmada kullanan büyük Amerikalı fizikçi DW Gibbs'den (1839-1903) almıştır. Gibbs enerjisi, aşağıdaki ilişkiler kullanılarak entalpi H ve entropi S cinsinden belirlenir: G = H - S, ∆G = ∆H - ∆S. Gibbs enerjisine dayanarak, termodinamiğin ikinci yasası aşağıdaki gibi formüle edilebilir: izobarik izotermal koşullar altında (p, T = const), sistemde yalnızca bu tür işlemler kendiliğinden meydana gelebilir, bunun sonucunda sistemin Gibbs enerjisi azalır (ΔG <0) Denge durumunda, Gibbs enerjisi sistem değişmez (G = const, AG = 0). ΔG < 0, p, T = sabit. Yukarıdakilerden, Gibbs enerjisinin biyoenerjetik süreçlerin incelenmesinde önemli bir rol oynadığı sonucu çıkar. Bu durum fonksiyonu ile biyolojik sistemlerde spontane süreçlerin yönünü tahmin edebilir ve elde edilebilecek maksimum verimi hesaplayabilirsiniz. Gibbs enerjisi G, entalpi H gibi, sistemin durumunun bir fonksiyonudur. Bu nedenle, Gibbs enerjisindeki ΔG değişim, entalpi ΔH'deki değişime benzer şekilde kimyasal dönüşümleri karakterize etmek için kullanılabilir. Bu reaksiyonlara karşılık gelen Gibbs enerji değişiminin gösterildiği reaksiyon denklemlerine de termokimyasal denir. Sistemin Gibbs enerjisinin azaldığı (ΔG < 0) ve iş yapıldığı kimyasal reaksiyonlara ekzergonik denir. Gibbs enerjisinin arttığı (ΔG > 0) ve sistem üzerinde iş yapılan reaksiyonlara endergonik denir. Termodinamiğin ikinci yasasından türetilen Gibbs enerjisi, durumun bir fonksiyonudur. Bu nedenle, entalpi için olduğu gibi, Gibbs enerjisi için de Hess yasası aşağıdaki biçimde formüle edilebilir: Sabit basınç ve sıcaklıkta verilen reaktiflerden verilen ürünlerin oluşumu sırasında Gibbs enerjisindeki değişim, bu ürünlerin oluşumuyla sonuçlanan reaksiyonların sayısına ve tipine bağlı değildir. Hess yasasının uygulanmasının önemli bir örneği, glikoz oksidasyonunun dioksijen ile reaksiyonunun Gibbs enerjisinin hesaplanmasıdır. Bu reaksiyondaki Gibbs enerjisindeki değişim, vücut dışında belirlenen p = 101 kPa ve T = 298°K'de ΔG° = 2880 kJ/mol'dür. Karşılık gelen termokimyasal denklem şu şekilde yazılır: С6Н12О6 + 6O2 = 6CO2 + 6Н2Oh, ΔGpya° = 2880 kJ/mol. Vücudun hücrelerinde bu reaksiyon, biyokimyacılar tarafından incelenen bir dizi ardışık aşamada gerçekleştirilir. Hess yasasından, tüm ara reaksiyonlardaki Gibbs enerji değişimlerinin toplamının ΔG olduğu tahmin edilebilir.pya: AG1 +ΔG2 +ΔG3 + … + ∆Gn = ∆Gpya 🇧🇷. Bir tepkimenin Gibbs enerjisi, stokiyometrik miktardaki ürünlerin oluşum enerjilerinin cebirsel toplamı ile stokiyometrik miktardaki reaktanların Gibbs oluşum enerjilerinin cebirsel toplamının çıkarılmasına eşittir: AGpya = (ncAGc + nDAGD)(NAAGA + nBAGB). 9. Çözümler. Çözümlerin sınıflandırılması Agregasyon durumuna göre çözeltiler gaz, sıvı ve katı olabilir. Herhangi bir çözüm, bu kavramlar biraz keyfi olmasına rağmen, çözünen maddelerden ve bir çözücüden oluşur. Örneğin, alkol ve su miktarının oranına bağlı olarak, bu sistem alkolün su içinde veya suyun alkol içinde bir çözeltisi olabilir. Genellikle, çözücünün, çözeltide, çözünmeden öncekiyle aynı kümelenme durumunda bulunan bileşen olduğu düşünülür. Çözümler doktrini hekimler için özel bir ilgi alanıdır çünkü en önemli biyolojik sıvılar - kan, lenf, idrar, tükürük, ter - sudaki tuzların, proteinlerin, karbonhidratların, lipitlerin çözeltileridir. Biyolojik sıvılar, besinlerin (yağlar, amino asitler, oksijen), ilaçların organlara ve dokulara taşınmasında ve ayrıca metabolitlerin (üre, bilirubin, karbondioksit vb.) vücuttan atılmasında rol oynar. Kan plazması hücreler için bir ortamdır - lenfositler, eritrositler, trombositler. Vücudun sıvı ortamında asitliğin sabitliği, tuzların ve organik maddelerin konsantrasyonu korunur. Bu sabitliğe konsantrasyon homeostazı denir. Çözümlerin sınıflandırılması Molar kütlesi 5000 g/mol'den az olan maddelerin çözeltilerine düşük moleküler ağırlıklı bileşiklerin (NMS) çözeltileri, 5000 g/mol'den daha büyük olan maddelerin çözeltilerine ise yüksek moleküler ağırlıklı bileşiklerin çözeltileri denir. HMC). Elektrolitik ayrışmanın varlığına veya yokluğuna göre, NMS çözeltileri iki sınıfa ayrılır - elektrolit çözeltileri ve elektrolit olmayan çözeltiler. Elektrolit çözeltileri - iyonlara ayrışan tuzların, asitlerin, bazların, amfolitlerin çözeltileri. Örneğin, KNO çözümleri3, HCl, KOH, Al(OH)3 , glisin. Elektrolit çözeltilerinin elektrik iletkenliği, çözücününkinden daha yüksektir. Elektrolit olmayan çözeltiler - pratik olarak suda ayrışmayan maddelerin çözeltileri. Örneğin, sakaroz, glikoz, üre çözeltileri. Elektrolit olmayan çözeltilerin elektrik iletkenliği, bir çözücününkinden çok az farklıdır. Kolloidal çözeltilerin aksine NMS çözeltilerine (elektrolitler ve elektrolit olmayanlar) doğru denir. Gerçek çözeltiler, bileşimin homojenliği ve çözünen ile çözücü arasında bir ara yüzün olmaması ile karakterize edilir. Çözünmüş parçacıkların (iyonlar ve moleküller) boyutu 10'dan azdır9m Çoğu RİA, molekülleri (makromoleküller) kimyasal bağlarla birbirine bağlanan çok sayıda tekrar eden grup veya monomerik birimlerden oluşan polimerlerdir. RİA çözeltilerine polielektrolit çözeltileri denir. Polielektrolitler arasında poliasitler (heparin, poliadenilik asit, poliaspartik asit, vb.), polibazlar (polilisin), poliamfolitler (proteinler, nükleik asitler) bulunur. HMS çözümlerinin özellikleri, NMS çözümlerinden önemli ölçüde farklıdır. Bu nedenle, ayrı bir bölümde ele alınacaktır. Bu bölüm, düşük moleküler ağırlıklı elektrolitler, amfolitler ve elektrolit olmayan çözeltilere ayrılmıştır. 10. Çözücü olarak su Gezegenimizdeki en yaygın çözücü sudur. Ortalama 70 kg ağırlığındaki bir insanın vücudunda yaklaşık 40 kg su bulunur. Aynı zamanda, hücrelerin içindeki sıvının üzerine yaklaşık 25 kg su düşer ve 15 kg, kan plazması, hücreler arası sıvı, beyin omurilik sıvısı, göz içi sıvısı ve gastrointestinal sistemin sıvı içeriğini içeren hücre dışı sıvıdır. Hayvan ve bitki organizmalarında su genellikle %50'den fazladır ve bazı durumlarda su içeriği %90-95'e ulaşır. Anormal özellikleri nedeniyle su, yaşam için mükemmel şekilde uyarlanmış benzersiz bir çözücüdür. Her şeyden önce su, iyonik ve birçok polar bileşikleri iyi çözer. Suyun bu özelliği büyük ölçüde yüksek dielektrik sabitinden (78,5) kaynaklanmaktadır. Suda yüksek oranda çözünür olan bir başka büyük madde sınıfı, şekerler, aldehitler, ketonlar ve alkoller gibi polar organik bileşikleri içerir. Sudaki çözünürlükleri, su moleküllerinin bu maddelerin polar fonksiyonel gruplarıyla, örneğin alkollerin ve şekerlerin hidroksil gruplarıyla veya aldehit ve ketonların karbonil grubunun oksijen atomuyla polar bağlar oluşturma eğilimiyle açıklanır. Aşağıda biyolojik sistemlerdeki maddelerin çözünürlüğü için önemli olan hidrojen bağlarına örnekler verilmiştir. Yüksek polaritesi nedeniyle su, maddelerin hidrolizine neden olur. Su, vücudun iç ortamının ana parçası olduğu için vücuttaki besinlerin ve metabolik ürünlerin emilim, hareket etme süreçlerini sağlar. Suyun, maddelerin, özellikle glikozun biyolojik oksidasyonunun son ürünü olduğuna dikkat edilmelidir. Bu işlemlerin bir sonucu olarak su oluşumuna, büyük miktarda enerjinin - yaklaşık 29 kJ / mol - salınması eşlik eder. Suyun diğer anormal özellikleri de önemlidir: yüksek yüzey gerilimi, düşük viskozite, yüksek erime ve kaynama noktaları ve sıvı halde katı halde olduğundan daha yüksek yoğunluk. Su, ortakların varlığı ile karakterize edilir - hidrojen bağları ile bağlanan molekül grupları. Suya olan afinitesine bağlı olarak, çözünmüş parçacıkların fonksiyonel grupları hidrofilik (su çeken), su ile kolayca çözülen, hidrofobik (suyu iten) ve amfifilik olarak ayrılır. Hidrofilik gruplar, polar fonksiyonel grupları içerir: hidroksil -OH, amino -NH2 , tiyol -SH, karboksil -COOH. Hidrofobik - polar olmayan gruplara, örneğin hidrokarbon radikallerine: CHXNUMX-(CH2)п -, İTİBAREN6Н5 -. Amino asitler, molekülleri her iki hidrofilik grubu (-OH, -NH) içeren maddeleri (amino asitler, proteinler) içerir.2 , -SH, -COOH) ve hidrofobik gruplar: (CH3 - (CH2)п ,-İTİBAREN6Н5-.) Amfifilik maddeler çözündüklerinde hidrofobik gruplarla etkileşim sonucu suyun yapısı değişir. Su moleküllerinin hidrofobik gruplara yakın sıralanma derecesi artar ve su moleküllerinin hidrofobik gruplarla teması en aza indirilir. Birleşen hidrofobik gruplar, su moleküllerini bulundukları yerin dışına iterler. 11. Çözeltinin konsantrasyonu ve nasıl ifade edileceği çözüm Denge durumundaki iki veya daha fazla maddenin değişken bileşimli homojen bir sistemine denir. Çözeltiyi oluşturan maddelere çözelti bileşenleri denir. Bir çözeltinin önemli bir özelliği konsantrasyonudur. Bu değer, çözümün birçok özelliğini belirler. madde konsantrasyonu (çözelti bileşeni), belirli bir çözelti veya çözücü kütlesi veya hacminde bulunan çözünen miktarı ile ölçülen bir miktardır. Konsantrasyonu ifade etmenin en yaygın kullanılan yolları şunlardır: kütle oranı, molar konsantrasyon, molar eşdeğer konsantrasyon, mol oranı, hacim oranı, titre. Kütle kesri W(X) birimin kesirleri, yüzde (%), ppm (yüzdenin binde biri) ve milyonda parça (ppm) olarak ifade edilir. Kütle oranı aşağıdaki formüllerle hesaplanır: W(X) = m(X)/m(yıl), W(X) = m(X)/m(yıl) × %100, nerede(X) - verilen X bileşeninin (çözünen), kg (g) kütlesi; m (yıl) çözeltinin kütlesidir, kg (g). Molar konsantrasyon mol/m olarak ifade edilir3 , mol/dm3 , mol/cm3 , mol/l, mol/ml. Tıpta mol / l birimlerinin kullanılması tercih edilir. Molar konsantrasyon aşağıdaki formülle hesaplanır: C(X) =n(X)/V(s.) = m(X)/M(X) ×V(rr), nerede(X) - sistemin çözünmüş maddesinin miktarı, mol; M(X) çözünenin molar kütlesi, kg/mol veya g/mol; m(X) sırasıyla, kg veya g çözünmüş maddenin kütlesidir; V(rr) - çözelti hacmi, l. Molar konsantrasyon b(X) mol/kg birimiyle ifade edilir. Kayıt formu, örneğin: b (HCl) \u0,1d XNUMX mol / kg. Molar konsantrasyonu aşağıdaki formüle göre hesaplayın: b(X) =n(X)/m(rl) = m(X)/M(X) ×m(rl) nerede(rl) - çözücü kütlesi, kg. Kimyada eşdeğer ve denklik faktörü kavramı yaygın olarak kullanılmaktadır. Eşdeğer belirli bir asit-baz reaksiyonunda bir hidrojen iyonuna veya belirli bir redoks reaksiyonunda - bir elektrona veya belirli bir tuzlar arasındaki değişim reaksiyonunda - bir birime eşdeğer olan X maddesinin gerçek veya koşullu bir parçacığı olarak adlandırılır. şarj. Hacim oranı f(X) bir birimin kesirleri veya yüzde olarak ifade edildiğinde, aşağıdaki formülle hesaplanır: Ф(X) = V(X)/v(rr) nerede v(X) - çözümün bu X bileşeninin hacmi; V(rr) çözücünün toplam hacmidir. Çözeltinin titresi T ile gösterilir(X), ölçü birimi - kg/cm3 , g/cm3 , g/ml. Çözeltinin titresi aşağıdaki formül kullanılarak hesaplanabilir: Т(X) = m(X)/v(rr) nerede(X) maddenin kütlesidir, genellikle g; V(rr) çözelti hacmi, ml. 12. Çözünme süreci Çözünme sürecinin doğası karmaşıktır. Doğal olarak, bazı maddelerin neden bazı çözücülerde kolayca çözünürken, diğerlerinde az çözünür veya pratik olarak çözünmez olduğu sorusu ortaya çıkar. Çözümlerin oluşumu her zaman belirli fiziksel süreçlerle ilişkilidir. Böyle bir süreç, bir çözünen ve bir çözücünün difüzyonudur. Difüzyon nedeniyle, parçacıklar (moleküller, iyonlar) çözünmüş maddenin yüzeyinden çıkarılır ve çözücünün hacmi boyunca eşit olarak dağıtılır. Bu nedenle karıştırma yokluğunda çözünme hızı difüzyon hızına bağlıdır. Ancak maddelerin çeşitli çözücülerdeki eşit olmayan çözünürlüklerini sadece fiziksel işlemlerle açıklamak mümkün değildir. Büyük Rus kimyager D. I. Mendeleev (1834-1907), kimyasal süreçlerin çözünmede önemli bir rol oynadığına inanıyordu. Sülfürik asit hidratlarının varlığını kanıtladı H2YANİ4H2EY2YANİ42H2EY2YANİ44H2O ve diğer bazı maddeler, örneğin, C2Н5OH3H2A. Bu durumlarda çözünme, çözünen maddenin parçacıkları ile çözücü arasında kimyasal bağların oluşmasıyla birlikte gerçekleşir. Bu işlem, çözücünün su olduğu özel durumda, hidrasyon olarak adlandırılır. Belirlendiği gibi, çözünen maddenin doğasına bağlı olarak, fiziksel etkileşimlerin bir sonucu olarak solvatlar (hidratlar) oluşabilir: iyon-dipol etkileşimi (örneğin, iyonik yapıya sahip maddeler (NaCI, vb.) çözülürken); dipol-dipol etkileşim - moleküler yapıya sahip maddeleri (organik maddeler) çözerken. Verici-alıcı bağları nedeniyle kimyasal etkileşimler gerçekleştirilir. Burada çözünen iyonlar elektron alıcılarıdır ve çözücüler (H2Ah, NH3) - elektron donörleri (örneğin, su komplekslerinin oluşumu) ve ayrıca hidrojen bağlarının oluşumunun bir sonucu olarak (örneğin, alkolün suda çözünmesi). Bir çözünenin bir çözücü ile kimyasal etkileşiminin kanıtı, termal etkiler ve çözünmeye eşlik eden renk değişimi ile sağlanır. Örneğin, potasyum hidroksit suda çözündüğünde ısı açığa çıkar: KOH + xN2O \uXNUMXd KOH (N2Ey; ΔH°çözüm = 55 kJ/mol. Sodyum klorür çözündüğünde ısı emilir: NaCI + xH2O = NaCI(H2Ey; ΔH°çözüm = +3,8 kJ/mol. 1 mol madde çözündüğünde açığa çıkan veya emilen ısıya denir. çözelti ısısı Qçözüm Termodinamiğin birinci yasasına göre Qçözüm = ΔHçözüm, nerede ΔHçözüm belirli bir miktardaki bir maddenin çözünmesiyle entalpideki değişimdir. Susuz beyaz bakır sülfatın suda çözünmesi yoğun mavi rengin ortaya çıkmasına neden olur. Solvatların oluşumu, renk değişimi, termal etkiler ve bir dizi başka faktör, oluşumu sırasında çözelti bileşenlerinin kimyasal yapısındaki bir değişikliği gösterir. Bu nedenle, modern kavramlara göre çözünme, hem fiziksel hem de kimyasal etkileşim türlerinin rol oynadığı fizikokimyasal bir süreçtir. 13. Çözünme sürecinin termodinamiği Termodinamiğin ikinci yasasına göre, p, T = const'ta, bu işlem sonucunda sistemin Gibbs enerjisi azalırsa, yani maddeler herhangi bir çözücüde kendiliğinden çözülebilir. ΔG = (ΔН - TΔS) < 0. ΔН değerine entalpi faktörü, TΔS değerine ise çözünmenin entropi faktörü denir. Sıvı ve katı maddeler çözündüğünde, çözünen maddeler daha düzenli bir durumdan daha az düzenli bir duruma geçtiğinden, sistemin entropisi genellikle artar (ΔS > 0). Çözünürlük artışına katkıda bulunan entropi faktörünün katkısı, özellikle yüksek sıcaklıklarda fark edilir, çünkü bu durumda T faktörü büyüktür ve TΔS ürününün mutlak değeri de sırasıyla büyüktür, Gibbs'deki azalma enerji artar. Gazlar bir sıvı içinde çözüldüğünde, çözünen madde daha az düzenli bir durumdan (büyük hacim) daha düzenli bir duruma (küçük hacim) geçtiği için sistemin entropisi genellikle azalır (ΔS < 0). Sıcaklıktaki bir düşüş gazların çözünmesini destekler, çünkü bu durumda T faktörü küçüktür ve TΔS ürününün mutlak değeri daha küçük olacaktır ve Gibbs enerjisindeki azalma daha büyük olacaktır, T değeri ne kadar düşükse. Bir çözeltinin oluşumu sırasında sistemin entalpisi de hem artabilir (NaCl) hem de azalabilir (KOH). Çözünme sürecinin entalpisindeki değişim, çözünme sürecine eşlik eden tüm süreçlerin endo ve ekzotermik katkılarının cebirsel toplamı olarak Hess yasasına göre düşünülmelidir. Bunlar, maddelerin kristal kafesinin tahrip edilmesinin endotermik etkileri, moleküllerin bağlarının kırılması, çözücünün başlangıç yapısının tahrip edilmesi ve solvatlar da dahil olmak üzere çeşitli etkileşim ürünlerinin oluşumunun ekzotermik etkileridir. Sunumun basitliği için, çözünme entalpisinin artışı ΔНçözüm enerji farkı E olarak temsil edilebilircr, çözünmüş maddenin kristal kafesinin ve E enerjisinin yok edilmesi için harcanantuzÇözünen parçacıkların çözücü molekülleri tarafından çözülmesi sırasında salınır. Başka bir deyişle, entalpi değişimi, entalpi değişiminin ΔH cebirsel toplamıdır.cr kristal kafesin tahrip olması ve ΔН entalpisindeki bir değişikliğin bir sonucu olaraktuz çözücü parçacıkları tarafından çözülme nedeniyle: ΔNçözüm = ΔHcr + ΔNtuz, nerede ΔHçözüm - çözünme sırasında entalpi değişimi. Bununla birlikte, asil gazların organik çözücüler içinde çözünmesine genellikle ısının, örneğin aseton, benzen, etanol ve sikloheksan içinde helyum ve neon gibi ısının emilmesi eşlik eder. Moleküler kristal yapıya sahip katıları ve sıvıları çözerken, moleküler bağlar çok güçlü değildir ve bu nedenle genellikle ΔHtuz > ΔNcr Bu, örneğin alkollerin ve şekerlerin çözünmesinin ekzotermik bir süreç olduğu gerçeğine yol açar (ΔHçözüm <0). İyonik kafesli katıları çözerken, enerji oranı Ecr ve Etuz farklı olabilir. Bununla birlikte, çoğu durumda, iyonların çözünmesi sırasında açığa çıkan enerji, kristal kafesin yok edilmesi için harcanan enerjiyi telafi etmez; bu nedenle, çözünme işlemi endotermiktir. Böylece termodinamik veriler, termodinamiğin birinci ve ikinci yasalarına dayalı olarak çeşitli maddelerin kendiliğinden çözünmelerini tahmin etmeyi mümkün kılar. 14. Çözünürlük Bir çözünen, bir çözücü ile temas halindeyse, çoğu durumda çözelti oluşumu süreci, belirli bir sınırlayıcı konsantrasyona ulaşılana kadar (doygunluk oluşur) kendiliğinden ilerler. Bu, dengeye ulaşıldığında, entalpi ve entropi faktörleri eşit olduğunda, yani ΔН = TΔS olduğunda gerçekleşir. Örneğin, kristaller bir sıvıya verildiğinde, moleküller veya iyonlar kristalin yüzeyinden çözeltiye geçer. Difüzyon nedeniyle, parçacıklar çözücünün hacmi boyunca eşit olarak dağılır. Çözünme doygunluğa doğru ilerler. Belirli bir sıcaklıkta maksimum miktarda çözünen içeren ve fazla çözünen ile dengede olan bir çözeltiye doymuş denir. Aşırı doymuş bir çözelti, konsantrasyonu doymuş bir çözeltiden daha yüksek olan bir çözeltidir. Doymuş bir çözeltiden daha düşük bir konsantrasyona sahip bir çözeltiye doymamış bir çözelti denir. Bir maddenin belirli bir çözücü içinde çözünme yeteneğine çözünürlük denir. Sayısal olarak, bir maddenin çözünürlüğü, doymuş çözeltisinin konsantrasyonuna eşittir. Çözünürlük, örneğin 1 litre doymuş çözeltide bulunan çözünen madde miktarı, mol/100 veya 100 g doymuş çözelti içindeki çözünenin kütlesi cinsinden konsantrasyonla aynı birimlerde ifade edilebilir. . Çözünürlük birimi, XNUMX g çözücü başına gramdır. Karşılık gelen değere çözünürlük katsayısı denir. Çözünürlük, çözünenin ve çözücünün doğasına, sıcaklığa, basınca ve çözeltideki diğer maddelerin varlığına bağlıdır. Bileşenlerin doğasının çözünürlüğüne etkisi Maddelerin çözünme kabiliyeti, X çözeltisinin bileşenlerinin molekülleri arasındaki etkileşim kuvvetlerinin doğası ile belirlenir.1 onlara2 : çözücü - çözücü (X1 - X1 ), çözünen - çözünen (X2 - X2 ), çözücü - çözünen (X1 - X2 ) (noktalar moleküler bağı gösterir). Maddelerin çözünürlüğü büyük ölçüde değişir. Örnekler, aynı çözücüde (su) farklı tuzların çözünürlüğünü ve aynı maddenin (AgNO) çözünürlüğünü göstermektedir.3 ) çeşitli çözücülerde. İyonik tipte bağa sahip maddeler ve polar moleküllerden oluşan maddeler su, alkoller gibi polar çözücülerde daha iyi çözünür. Bu çözücüler, yüksek dielektrik sabiti ile karakterize edilir. Maddelerin yüksek çözünürlüğü, çoğunlukla moleküller arası, özellikle hidrojen bağlarının oluşumundan kaynaklanır. Bu nedenle, su ve alkolün sınırsız karşılıklı çözünürlüğü, su ve alkol molekülleri arasındaki hidrojen bağlarının oluşumu ile açıklanır ve AgcI kristallerinin sulu bir amonyak çözeltisinde çözünmesi, bir kimyasal verici-alıcı bağının oluşumu ile açıklanır. amonyak moleküllü gümüş iyonu (AgCI pratik olarak suda çözünmez). Aynı nedenle, düşük geçirgenliğe sahip bir çözücü olan piridin, çok yüksek bir çözünürlük sergiler. Çözünürlük gerçek dengeyi karakterize ettiğinden, dış koşulların bu durum üzerindeki etkisi (basınç, sıcaklık) Le Chatelier ilkesi kullanılarak niteliksel olarak tahmin edilebilir. Bu tür değerlendirmeler, derin dalış pratiğinde, sıcak mağazalarda vs. çalışırken gereklidir. 15. Gazların sıvılarda çözünürlüğü. Henry-Dalton ve Sechenov Kanunları Gazların sıvılarda çözünmesine hemen hemen her zaman ısı salınımı eşlik eder. Bu nedenle, gazların çözünürlüğü, Le Chatelier ilkesine göre artan sıcaklıkla azalır. Bu model genellikle sudaki çözünmüş gazları (örn. CO02) kaynatarak uzaklaştırmak için kullanılır. Bazen bir gazın çözünmesine, ısının emilmesi eşlik eder (örneğin, bazı organik çözücülerde soy gazların çözünmesi). Bu durumda sıcaklığın artması gazın çözünürlüğünü artırır. Bir gaz, bir sıvı içinde süresiz olarak çözünmez. Belirli bir gaz konsantrasyonunda X, bir denge kurulur:  Bir gaz bir sıvı içinde çözündüğünde, sistemin hacminde önemli bir azalma meydana gelir. Bu nedenle, Le Chatelier ilkesine göre basınçtaki bir artış, dengenin sağa kaymasına, yani gazın çözünürlüğünde bir artışa yol açmalıdır. Gaz belirli bir sıvı içinde az çözünürse ve basınç düşükse, gazın çözünürlüğü basıncıyla orantılıdır. Bu bağımlılık Henry yasası (1803) ile ifade edilir: dengede belirli bir sıvı hacminde belirli bir sıcaklıkta çözünen gaz miktarı, gazın basıncı ile doğru orantılıdır. Henry yasası aşağıdaki biçimde yazılabilir: с (X) =Kr(X) × S(X) doymuş bir çözeltideki gaz konsantrasyonu nerede, mol/l; P(X) - çözelti üzerindeki gaz basıncı X, Pa; Kr(X) - X gazı için Henry sabiti, mol × l1 × Pa1 . Henry sabiti gazın, çözücünün ve sıcaklığın doğasına bağlıdır. Henry yasası, yalnızca nispeten seyreltik çözeltiler için, düşük basınçlarda ve çözünmüş gazın molekülleri ile çözücü arasında kimyasal etkileşim olmadığında geçerlidir. Henry yasası, genel Dalton yasasının özel bir halidir. Gaz halindeki bir maddenin değil, bir gaz karışımının çözünmesinden bahsediyorsak, her bileşenin çözünürlüğü Dalton yasasına uyar: gaz karışımının bileşenlerinin her birinin sabit bir sıcaklıkta çözünürlüğü, bileşenin sıvının üzerindeki kısmi basıncıyla orantılıdır ve karışımın toplam basıncına ve diğer bileşenlerin bireyselliğine bağlı değildir. Başka bir deyişle, bir sıvı içinde gaz karışımının çözünmesi durumunda, kısmi basınç p! bu bileşen. Bir bileşenin kısmi basıncı, bileşenin basıncının gaz karışımının toplam basıncına oranı olarak anlaşılır: Рi/ Rtoplum Bileşenin kısmi basıncı formülle hesaplanır. Elektrolitlerin varlığında sıvılarda gazların çözünürlüğünü inceleyen Rus fizyolog I. M. Sechenov (1829-1905) aşağıdaki modeli oluşturdu (Sechenov yasası): elektrolitlerin varlığında sıvılarda gazların çözünürlüğü azalır; gazlar çıkar. Рi = Ptoplum ×(Xi) nerede pi - X bileşeninin kısmi basıncıi; Рtoplum gaz karışımının toplam basıncı; x(Xi) i'inci bileşenin mol kesridir. Elektrolitlerin varlığında sıvılarda gazların çözünürlüğünü inceleyen Rus fizyolog I. M. Sechenov (1829-1905) aşağıdaki modeli oluşturdu (Sechenov yasası): elektrolitlerin varlığında sıvılarda gazların çözünürlüğü azalır; gazlar çıkar. 16. Biyolojik sistemlerde maddelerin transfer süreçlerinde difüzyonun rolü Difüzyon biyolojik sistemlerde önemli bir rol oynar. Öncelikle doku sıvılarında besinlerin ve metabolik ürünlerin hareketi difüzyon yoluyla gerçekleşir. Ek olarak, çoğu durumda, canlı organizmalardaki fizikokimyasal süreçlerin hızı, reaktanların difüzyon hızı ile belirlenir, çünkü reaktanların difüzyonu genellikle sürecin en yavaş aşamasıdır, enzimleri içeren biyokimyasal reaksiyonlar ise çok hızlı ilerler. Her canlı hücre, hücre içi ortamı korumaya ve düzenlemeye hizmet eden bir zarla çevrilidir. Maddeler zarlardan iki ana mekanizma ile geçerler: sıradan difüzyon (pasif taşıma) ve enerjik olarak aktive edilmiş transfer (aktif taşıma). Membranın iç tabakası hidrokarbon zincirlerinden oluşur. Bu nedenle, birçok küçük nötr molekül ve polar olmayan HMS molekülü bu katmanda çözünür ve bir konsantrasyon gradyanı boyunca normal difüzyonla zardan geçebilir. Bu tür maddelerin taşınmasına pasif denir. Difüzyon, akciğerlerdeki kanın oksijenlenmesi sürecinde önemli bir rol oynar. Büyük dallanma nedeniyle akciğer alveollerinin yüzeyi büyüktür (~ 80 m2), bu nedenle oksijen plazmada aktif olarak çözülür ve eritrositlere girer. Venöz kanda oksijen tükenir - venöz kandaki oksijen konsantrasyonu sıfır olma eğilimindedir. Bu nedenle, atmosfer ile akciğerlere giren kan arasındaki oksijen konsantrasyonu gradyanı yüksektir ve bu da aktif alımla sonuçlanır (Fick yasasına göre). Maddelerin bir eğime karşı daha düşük konsantrasyonlu bir alandan daha yüksek konsantrasyonlu bir alana hareketine aktif taşıma denir. Böyle bir süreç kendiliğinden ilerleyemez ve enerji maliyeti gerektirir. Enerji kaynağı, biyoinorganik bir bileşik olan adenosin trifosfatın (ATP) ekzoergonik hidroliz reaksiyonudur. K iyonlarının zardan hücreye akışı, pasif difüzyon nedeniyle hücreden K iyonlarının akışına eşit olduğunda, K iyon konsantrasyonlarının hücre içinde ve dışında sabit bir sabit dağılımı elde edilir. Na iyonları için dağılım (iyon homeostazı) benzer şekilde elde edilir, sadece aktif taşıma ve telafi edici pasif iyon difüzyonu, karşılık gelen K iyon akışlarının tersine yönlendirilir. Difüzyon işlemi tıpta yaygın olarak kullanılmaktadır. Örneğin, düşük moleküler ağırlıklı maddelerin yarı geçirgen bir zardan bir konsantrasyon gradyanı boyunca difüzyonunun seçiciliğine dayanan diyaliz yöntemi, klinik uygulamada bir "yapay böbrek" aparatı oluşturmak için kullanılır. RİA parçacıkları yarı geçirgen bir zardan geçmez, bu nedenle biyolojik sıvılar (örneğin, kan plazması) diyaliz yoluyla zararlı düşük moleküler maddelerden - "cüruflardan" (üre, ürik asit, bilirubin, aminler, fazla K iyonları) arındırılabilir. çeşitli hastalıklarda birikir. Saflaştırma sırasında, damardan alınan hasta kanı, içinden NMS'nin yayılabileceği ve plazmadan çıkarılabileceği yarı geçirgen membranlı özel haznelere girer. Bir dizi enflamatuar hastalıkta protein yıkımı meydana gelir ve kan plazmasında NMS ile birlikte çıkarılması gereken protein parçaları (peptitler ve polipeptitler) vardır. 17. Çözeltilerin donma noktasının düşürülmesi ve kaynama noktasının yükseltilmesi Çözelti üzerindeki buhar basıncının azalmasının doğrudan bir sonucu, donma noktası ΔT'deki bir değişikliktir.з ve çözeltilerin kaynama noktası ΔTк saf bir çözücü için bu miktarların değerleri ile karşılaştırılır. Bu nicelikler arasındaki ilişkiler, termodinamiğin ikinci yasasından da kaynaklanmaktadır. Bir sıvının kaynama noktası, buhar basıncının dış basınca eşit olduğu sıcaklıktır (örneğin, 101,3 kPa'da suyun kaynama noktası 100 °C'dir). Bir sıvının donma noktası (kristalleşme), sıvı üzerindeki buhar basıncının katı faz üzerindeki buhar basıncına eşit olduğu sıcaklıktır. T3 ve Tk çözeltisinin donma ve kaynama noktalarını ve T ° çözücüsü için aynı değerleri belirlersek3 ve T°к , sonra şunu elde ederiz: ΔTk = Tк - T°к > 0, ΔT3 = T°3 - T3 > 0. Çözeltilerin kaynama noktasını artırmanın ve donma noktasını düşürmenin etkileri, Le Chatelier ilkesi kullanılarak niteliksel olarak açıklanabilir. Gerçekten de, eğer bir denge sisteminde "sıvı - buhar" ise (örneğin, H2О(G) - H2О(G)), çözünür, uçucu olmayan bir madde tanıtın, daha sonra çözücünün çözelti üzerindeki buhar basıncı azalacaktır. Buhar basıncındaki düşüşü telafi etmek ve önceki denge durumuna ulaşmak için, proses endotermik olduğundan çözeltinin daha yüksek bir sıcaklığa (373°K'den fazla) ısıtılması gerekir. Bir "katı faz - sıvı" denge sistemi olsun, örneğin H2О(T) > H2О(G), 273°K'de. Belirli bir miktar uçucu olmayan (katı fazda çözünmeyen) bir madde sıvı fazda çözülürse, sıvı fazdaki su moleküllerinin konsantrasyonu azalır. Le Chatelier ilkesine uygun olarak, sıvı fazdaki su miktarını artırmak için bir süreç başlayacak - buzun erimesi. Yeni bir denge kurmak için çözeltinin soğutulması, yani işlem ekzotermik olduğu için sıcaklığın düşürülmesi gerekir. Raoult'un seyreltik çözeltiler yasasına göre, buhar basıncındaki azalma çözeltinin konsantrasyonu ile orantılıdır. Bu nedenle, bu tür çözeltilerin kaynama noktasındaki artış ve donma noktasındaki düşüş, konsantrasyonlarının artmasıyla artmalıdır. Çözeltilerin donmasını ve kaynamasını inceleyen Raul, şunları buldu: kaynama noktasında ΔT bir artışк ve donma noktasının düşürülmesi ΔТ3 elektrolit olmayan seyreltik çözeltiler, çözeltinin molar konsantrasyonu ile doğru orantılıdır: ΔTк =Kэb(X), ΔT3 = Kз b(X), nerede(X) - molar konsantrasyon, mol/kg; Кз ve Kэ - orantılılık katsayıları, kg × K × mol1 sırasıyla ebulliometrik ve kriyometrik sabitler olarak adlandırılır. K sabitlerinin fiziksel anlamıэ ve Kз b'yi kabul edersek netleşir(X) = 1. Sonra Kэ = ΔTк ve Kз = ΔTз . Başka bir deyişle, ebulliometrik sabit sayısal olarak bir molar çözeltinin kaynama noktasındaki artışa eşittir ve kriyometrik sabit sayısal olarak bir molar çözeltinin donma noktasındaki azalmaya eşittir. Ebuliometrik ve kriyometrik sabitler yalnızca çözücünün yapısına bağlıdır ve çözünenin (ideal çözeltiler) yapısına bağlı değildir. 18. Ozmotik basınç Osmoz, çözücü moleküllerinin yarı geçirgen bir zardan bir çözücüden bir çözeltiye veya daha düşük konsantrasyonlu bir çözeltiden daha yüksek konsantrasyonlu bir çözeltiye ağırlıklı olarak tek taraflı penetrasyonudur. Ozmozun meydana gelmesi için gerekli bir koşul, bir çözücünün ve yarı geçirgen bir zarla ayrılmış farklı konsantrasyonlarda bir veya iki çözeltinin varlığıdır. Termodinamik açısından bakıldığında, ozmozun itici gücü, sistemin konsantrasyonları eşitleme eğilimidir, çünkü bu durumda sistemin entropisi artar, çünkü sistem daha az düzenli bir duruma geçtiğinden, sistemin Gibbs enerjisi buna göre azalır ve kimyasal potansiyeller eşitlenir. Bu nedenle, ozmoz kendiliğinden bir süreçtir. Basit bir deney, ozmoz mekanizması ile bir çözelti üzerinde buhar basıncındaki bir değişiklik arasındaki bağlantıyı açıklayan bir örnek olarak hizmet edebilir. Saf çözücülü bir cam ve uçucu olmayan bir madde çözeltisine sahip bir cam (kaplardaki sıvıların seviyeleri aynıdır) kapalı bir cam kaba konursa, bir süre sonra içindeki sıvının seviyesi birinci bardak azalacak ve ikinci bardaktaki çözeltinin seviyesi artacaktır. Bu durumda, çözücü birinci beherden ikinci behere geçer, bu da (Raoult yasasına göre) çözücünün çözelti üzerindeki buhar basıncının saf çözücüye göre daha düşük olmasına bağlıdır. Böylece çözücü ile çözelti arasındaki hava boşluğu yarı geçirgen bir zar görevi görür. Yarı geçirgen duvarlı bir kabı sulu bir glikoz çözeltisiyle dolduralım ve başka bir kaba suyla yerleştirelim, böylece bu kaplardaki sıvıların seviyeleri çakışsın. Osmoz sonucunda birinci kaptaki çözeltinin hacmi artar ve bu kaptaki sıvı seviyesi giderek yükselir. Bu, ozmozu önleyen ek bir hidrostatik basınç oluşturur. Ozmotik dengede sıvı kolonunun hidrostatik basıncı, çözeltinin ozmotik basıncını belirler. Ozmotik basınç ozmozu durdurmak için çözeltiye uygulanması gereken minimum hidrolik basınç ile ölçülen değerdir. Ozmotik basınç kanunları. Van't Hoff, elektrolit olmayanların seyreltik çözeltilerinin ozmotik basıncını hesaplamak için ampirik bir denklem önerdi: π = C(X)rt, nerede π - ozmotik basınç, kPa; С(X) - molar konsantrasyon, mol/l; R evrensel gaz sabitidir 8,31 kPa - l / (mol - K); T mutlak sıcaklıktır, K. Van't Hoff yasası deneysel veriler temelinde oluşturulmuş olsa da, ΔG = 0'daki termodinamik denge koşullarından türetilebilir. Bu nedenle, bu yasa termodinamiğin ikinci yasasının bir sonucu olarak düşünülmelidir. Yukarıdaki formdaki ifade, ideal gazlar için Clapeyron-Mendeleev denklemine benzer, ancak bu denklemler farklı süreçleri tanımlar. 19. Biyolojik sistemlerde ozmoz ve ozmotik basıncın rolü Osmoz olgusu birçok kimyasal ve biyolojik sistemde önemli bir rol oynar. Osmoz, suyun hücrelere ve hücreler arası yapılara akışını düzenler. Dokuların esnekliğini ve belirli bir organ şeklinin korunmasını sağlayan hücrelerin esnekliği (turgor), ozmotik basınçtan kaynaklanır. Hayvan ve bitki hücrelerinin kabukları veya yarı geçirgen zarların özelliklerine sahip bir yüzey protoplazma tabakası vardır. Bu hücreler farklı konsantrasyonlardaki solüsyonlara yerleştirildiğinde ozmoz görülür. Aynı ozmotik basınca sahip çözeltilere izotonik denir. İki çözelti farklı ozmotik basınca sahipse, yüksek ozmotik basınca sahip çözelti ikinciye göre hipertoniktir ve ikincisi birinciye göre hipotoniktir. Hücreler izotonik bir çözeltiye yerleştirildiğinde, boyutlarını korurlar ve normal şekilde çalışırlar. Hücreler hipotonik bir çözeltiye yerleştirildiğinde, daha az konsantre bir dış çözeltiden gelen su hücrelere geçer, bu da şişmelerine ve ardından zarların yırtılmasına ve hücresel içeriğin dışarı çıkmasına neden olur. Hücrelerin bu tahribatına lizis, kırmızı kan hücrelerinde ise bu işleme hemoliz denir. Hemoliz sırasında hücresel içeriği olan kana renginden dolayı vernik kanı denir. Hücreler hipertonik bir çözeltiye yerleştirildiğinde, su hücreleri daha konsantre bir çözelti içinde bırakır ve hücrelerin buruşması (kuruması) gözlenir. Bu fenomene plazmoliz denir. İnsan biyolojik sıvıları (kan, lenf, doku sıvıları), düşük moleküler bileşiklerin - NaCI, KCl, CaCl, yüksek moleküler bileşiklerin - proteinler, polisakkaritler, nükleik asitler ve oluşturulmuş elementler - eritrositler, lökositler, trombositlerin sulu çözeltileridir. Toplam eylemleri, biyolojik sıvıların ozmotik basıncını belirler. 310°K'de (37°C) insan kanının ozmotik basıncı 780 kPa'dır (7,7 atm). Aynı basınç, %0,9 NaCl sulu çözeltisi (0,15 mol/l) tarafından oluşturulur, bu nedenle kanla (tuzlu su) izotoniktir. Ancak kanda Na ve C1 iyonlarının yanı sıra RİA ve şekillendirilmiş elementlerin yanı sıra başka iyonlar da vardır. Bu nedenle, tıbbi amaçlar için, kanı oluşturanlarla aynı bileşenleri ve aynı miktarda içeren solüsyonların kullanılması daha doğrudur. Bu solüsyonlar ameliyatta kan yerine kullanılır. İnsan vücudu, ozmotik basınca ek olarak, sabitlik (homeostaz) ve asitlik gibi kanın diğer fizikokimyasal göstergeleri ile karakterize edilir. Kanın ozmotik basıncındaki izin verilen dalgalanmalar çok küçüktür ve şiddetli patolojide bile onlarca kPa'yı geçmez. Çeşitli prosedürlerde, insan ve hayvanların kanına büyük miktarlarda sadece izotonik çözeltiler enjekte edilebilir. Büyük kan kayıpları ile (örneğin, büyük ameliyatlardan, yaralanmalardan sonra), hastalara kanla sıvı kaybını telafi etmek için birkaç litre izotonik solüsyon enjekte edilir. Osmoz fenomeni tıbbi uygulamada yaygın olarak kullanılmaktadır. Bu nedenle, ameliyatta, pürülan yaralara enjekte edilen hipertonik sargılar (hipertonik% 10 NaCl çözeltisine batırılmış gazlı bez) kullanılır. Ozmoz yasasına göre, yara sıvısının gazlı bez içinden akımı dışa doğru yönlendirilir, bunun sonucunda yara sürekli olarak irin, mikroorganizmalar ve çürüme ürünlerinden temizlenir. 20. Ayrışma derecesi (iyonizasyon). elektrolitlerin gücü Neredeyse tamamı iyonlarına ayrışan (iyonlaşan) elektrolitlere güçlü elektrolitler, tamamen iyonlaşmayan elektrolitlere zayıf elektrolitler denir. Zayıf elektrolitlerin bir çözeltisinde iyonlarla birlikte iyonize olmayan moleküller vardır. S. Arrhenius, zayıf elektrolit çözeltilerinin izotonik katsayısının neden bir tam sayıya eşit olmadığını, eksik iyonizasyonla açıkladı. Ayrışmanın eksiksizliğini nicel olarak karakterize etmek için, ayrışma derecesi (iyonizasyon) kavramı tanıtılır. Bir elektrolitin ayrışma (iyonlaşma) derecesi, iyonlara ayrışan moleküllerin sayısının çözeltiye katılan toplam molekül sayısına oranıdır. Başka bir deyişle an, iyonlara ayrışan elektrolit moleküllerinin oranıdır. Ayrışma derecesi, bir birimin yüzdesi veya kesirleri olarak ifade edilir: αн = Nн/ Kp, burada N, iyonlara ayrışan elektrolit moleküllerinin sayısıdır; Np çözeltiye verilen elektrolit moleküllerinin sayısı (çözünmüş). Yani C için(CHXNUMXCOOH) = 0,1 mol/l, ayrışma derecesi αн = 0,013 (veya %1,3). Ayrışma derecesine göre, elektrolitler geleneksel olarak güçlü (αн > %30) ve zayıf (αн < 3%). Aralıkta, elektrolitlerin orta kuvvette olduğu kabul edilir. Hemen hemen tüm tuzlar güçlü elektrolitler olarak kabul edilir. En önemli asit ve bazlardan H2SO4 , HCI, HBr, HI, HNO3 , NaOH, KOH, Ba(OH)2 . Zayıf elektrolitler, çoğu organik asidin yanı sıra bazı inorganik bileşikleri içerir - H2S, HCN, N2İLE3 , BÖYLE3 , HCl0, N2ÜZERİNDE3İÇİNDE3 ,Hg2CI2 ,Fe(SCN)3 . An, elektrolit çözeltilerinin ortak özelliklerinin ideal çözümler için teorik bağımlılıklardan sapması ölçülerek deneysel olarak belirlenir. Örneğin, izotonik katsayı i, kriyoskopik yöntemle belirlenir, ardından ayrışma derecesi hesaplanır.Güçlü elektrolitler için, neredeyse tamamen iyonlara ayrıştıkları için ayrışma derecesi açıktır. İzotonik katsayı i'nin tamsayı bilgisinden sapması, onlar için çözeltide ilişkisiz moleküllerin varlığı ile değil, başka nedenlerle açıklanır. Ayrışmaya, ısının salınması veya emilmesi eşlik eder. Bu nedenle, ayrışma derecesi sıcaklığa bağlı olmalıdır. Sıcaklığın etkisi Le Chatelier ilkesine göre tahmin edilebilir. Elektrolitik ayrışma, ısının emilmesiyle gerçekleşirse, artan sıcaklıkla artar, ısının salınmasıyla birlikte azalır. Elektrolitik ayrışma derecesi, çözeltinin konsantrasyonundan etkilenir. Çözelti seyreltildiğinde, ayrışma derecesi önemli ölçüde artar. Bu bağlamda, elektrolitlerin gücünün ayrışma derecesine göre belirtilen sınıflandırması αн sadece yaklaşık 0,1 mol/l konsantrasyona sahip çözeltiler için geçerlidir. Elektrolitik ayrışmayı tersinir bir denge süreci olarak düşünürsek, o zaman Le Chatelier ilkesine göre su ile seyreltme damıtılmış moleküllerin sayısını arttırır, yani ayrışma derecesi artar. Zayıf elektrolitlerin ayrışma derecesi, aynı adı taşıyan iyonların eklenmesinden de etkilenir. Böylece, zayıf bir elektrolitin denge sistemine dahil edilmesi, iyonların konsantrasyonunu arttırır, bu da Le Chatelier ilkesine göre, ayrışma dengesinin sola doğru önemli bir kaymasına, yani ayrışma derecesinde bir azalmaya yol açar. . Bu nedenle, zayıf bir elektrolit çözeltisine aynı adı taşıyan iyonların eklenmesi, ayrışma derecesini azaltır. 21. Ayrışma sabiti. Ostwald'ın üreme yasası. Güçlü elektrolitlerin çözeltileri teorisi Kantitatif olarak, bir denge tersinir süreç olarak elektrolitik ayrışma, kütle hareketi yasası tarafından belirlenen bir ayrışma (iyonizasyon) sabiti ile karakterize edilebilir. Kütle eylemi yasası, kesinlikle, tersinir reaksiyonlara, yani zayıf elektrolit çözeltilerine uygulanır. Örneğin, KtnAnm elektrolitinin ayrışması bir denge süreci olarak gösterilebilir: Ktn Anm × nKtm+ +mAn . Kütle eylemi yasasına göre, denge sabiti aşağıdaki gibi yazılır: КД = (ktm+)n+(Birn)m + (KtnAnm) nerede (Ktm+) ve birn ) - elektrolit iyonlarının molar denge konsantrasyonları; (KtnAnm) ayrışmamış elektrolit moleküllerinin molar denge konsantrasyonudur; КД ayrışma sabiti denilen denge sabitidir. Bu denklem sadece zayıf elektrolitlerin seyreltik çözeltileri için geçerlidir. Konsantre çözeltilere ve güçlü elektrolit çözeltilerine uygulandığında denklem değiştirilmelidir. Ayrışma sabiti K ne kadar büyük olursaД , elektrolit daha fazla ayrışır. Ayrışma derecesinin aksine KД yalnızca çözücünün doğasına, elektrolite ve sıcaklığa bağlıdır, ancak çözeltinin konsantrasyonuna bağlı değildir. Bu nedenle, elektrolitik ayrışmanın hem sabiti hem de derecesi, ayrışmanın kantitatif özellikleridir. Doğal olarak, aralarında bir bağlantı vardır. Polibazik asitler ve poliasit bazlar adım adım ayrışır. Örneğin, fosforik asidin ayrışması üç adımda gerçekleşir:  Benzer şekilde poliasit bazlar için (örneğin, Ca(OH)2) - ayrışma iki adımda gerçekleşir. Kademeli ayrışma, elektrolitin sonraki her aşamada ayrışmasının bir öncekinden daha az ölçüde gerçekleşmesi ile karakterize edilir. Ayrışma sabitlerindeki değişimin bu karakteri, Coulomb yasası temelinde elektrostatik çekim ile açıklanabilir. Bir iyon nötr bir elektrolit molekülünden ayrıldığında iyonlaşma enerjisi minimumdur. Ayrışmanın sonraki her adımında bir iyonun ayrılması, artan enerji gerektirir, çünkü bir iyonun çıkarılması, sonraki adımlarda yükü daha büyük hale gelen bir parçacıktan meydana gelir. Çözeltilerinin konsantrasyonuna bakılmaksızın, güçlü elektrolitlerin iyonlara neredeyse tamamen ayrışması, fiziksel ve fizikokimyasal araştırma yöntemleriyle doğrulanır. Böylece seyreltik çözeltilerde tüm kuvvetli asitlerin kuvvetli bazlar tarafından nötralizasyon ısısı değerleri hemen hemen aynıdır. Asit ve bazın yapısından bağımsız olarak aynı AH=56,5 kJ/mol değeri elde edilir. Bu gerçek, seyreltik asit ve baz çözeltilerinin tamamen ayrıştığının açık bir kanıtıdır. Her durumda, nötralizasyon sırasında ortaya çıkan ortak süreç, bir moldeki iyonların kombinasyonudur. 22. Asitler ve bazlar teorisi Birçok elektrolit, özellikle çeşitli E elementlerinin hidroksitleri, asitlerin veya bazların özelliklerini sergiler. EON hidroksitin ayrışması iki tipte ilerleyebilir: 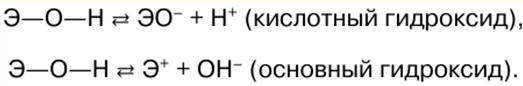 Boşluk, grubun her iki bağı boyunca da oluşabilir. E-O-N. Bilindiği gibi, bağların polaritesi ve gücü, elementlerin elektronegatifliğindeki farka, atomların boyutuna ve etkin yüküne bağlıdır. O-H bağının kopma enerjisi E-O bağının kopma enerjisinden çok daha az ise, hidroksitin ayrışması asit tipine göre ilerler. Aksine, O-H bağının kırılma enerjisi, E-O bağının kırılma enerjisinden çok daha büyükse, o zaman ayrışma ana tipe göre ilerler. Alkali ve toprak alkali metallerin hidroksitlerinde ve ayrıca düşük oksidasyon durumlarındaki geçiş metallerinde, E-O bağının gücü nispeten düşüktür, oksijen hidrojene daha güçlü bir şekilde bağlanır ve E-O-H ayrışması esas olarak bazik tipe göre ilerler, yani, hidroksit dionun ortadan kaldırılması ile. Bunun nedeni, bu tür elementlerin iyonlarının boyut olarak oldukça büyük olması ve küçük bir etkin yüke sahip olmaları, yani zayıf bir polarizasyon kabiliyetine sahip olmalarıdır. Oksidasyon derecesindeki bir artışla, E atomunun polarizasyon etkisi artar (özgül yükte bir artış), oksijen E elementine daha sıkı bağlanır ve E-O-H'nin ayrışması esas olarak asidik tipte, yani hidrojen iyonu ayrılır. İkincisi, oksijen atomundaki elektron yoğunluğunun yeniden dağılımı ile bağlantılıdır. Sonuç olarak, E-O bağı güçlenir ve OH bağı zayıflar. Şu anda, herhangi bir çözücüdeki asit-baz etkileşimlerini karakterize etmek için eşit olarak kullanılabilecek asit ve baz kavramlarının açık bir tanımı yoktur. Sulu çözeltilerdeki birçok elektroliti karakterize etmek için Arrhenius tarafından verilen asit ve baz kavramlarını kullanmak hala mümkündür: 1) asit, hidrojen iyonları H oluşturmak üzere çözeltilerde ayrışan bir elektrolittir; 2) baz, OH hidroksit iyonlarının oluşumu ile çözeltilerde ayrışan bir elektrolittir; 3) amfolit (amfoterik hidroksit), hem hidrojen iyonları hem de hidroksit iyonları oluşturmak üzere çözelti içinde ayrışan bir elektrolittir. Amfolitler, çinko, alüminyum, krom ve diğer amfoterik elementlerin hidroksitlerini ve ayrıca amino asitleri, proteinleri, nükleik asitleri içerir. Le Chatelier ilkesinin asit-baz denge zincirine uygulanması, sistemdeki OH hidroksit iyonlarının konsantrasyonundaki artışla asit tipi ayrışma olasılığının arttığını gösterir. Sistemdeki H+ hidrojen iyonlarının konsantrasyonundaki bir artış, ana türe göre baskın ayrışmaya yol açar. Bu, asidik bir ortamda amfolitin bazik bir karakter sergilediği ve alkali bir ortamda asidik bir karakter sergilediği anlamına gelir. Örneğin çinko hidroksit, asitlerle etkileşime girdiğinde bir baz gibi davranır: Zn (OH)2 + 2HCI - ZnCI2 + 2Н2Oh, ve alkalilerle etkileşime girdiğinde - bir asit olarak: Zn(OH)2+ 2NaOH → Na2[Zn(OH)4]. 23. Kan tampon sistemleri Kan plazması Tampon sistemleri, organizmaların asit-baz dengesinin korunmasında büyük önem taşımaktadır. Tüm canlı organizmaların hücre içi ve hücre dışı sıvıları, tampon sistemleri yardımıyla korunan sabit bir pH değeri ile karakterize edilir. Çoğu hücre içi sıvının pH değeri 6,8 ila 7,8 aralığındadır. İnsan kanındaki KO dengesinin asit-baz dengesi hidrojen-karbonat, fosfat ve protein tampon sistemleri ile sağlanır. Kan plazmasının normal pH değeri 7,40 ± 0 05'tir. Bu, 3,7 ila 4,0x108 mol/l arasındaki aktif asitlik değerleri aralığına karşılık gelir. Kanda çeşitli elektrolitler bulunduğundan (HC03 , H2CO3 , N2RO4 , NRO42 ), proteinler, amino asitler, yani bir (H +) aktivitesi belirtilen aralıkta olacak şekilde ayrışırlar. Plazma ve kan hücrelerindeki inorganik ve organik madde içeriği aynı olmadığından, bu kan bileşenlerinin ayrı ayrı ele alınması tavsiye edilir. kan plazması HCO tampon sistemi3 / N2İLE3 karbonik asitten oluşur2İLE3 ve konjuge baz HCO3 . Kandaki en önemli tampon sistemidir. Bileşenlerden biri karbonik asit H'dir.2İLE3 - plazmada çözünmüş CO'nun etkileşimi ile oluşur2 su ile: İLE2(r) + K2Tavuk2İLE3. nerede CO2(r) - çözünmüş CO konsantrasyonu2 . Bu reaksiyonun denge sabiti: K = [N2İLE3] / [CO2] CO arasında2 akciğerlerin kılcal damarlarından akan kan plazmasındaki alveollerde ve hidrojen-karbonat tamponunda bir denge zinciri kurulur. Hidrojen karbonat tampon sistemi, pH 7,4'e yakın etkili bir fizyolojik tampon görevi görür. Asitlerin kanına girdikten sonra - H bağışçıları+ zincirdeki denge, Le Chatelier ilkesine göre, HCO iyonları nedeniyle sola kayar.3 H iyonlarını H moleküllerine bağlar2İLE3 . Aynı zamanda, H konsantrasyonu2İLE3 artar ve HCO iyonlarının konsantrasyonu3 iner. H konsantrasyonunun arttırılması2İLE3 dengenin sola kaymasına yol açar (Le Chatelier ilkesi). Çürümeye neden olur2İLE3 ve CO konsantrasyonunda bir artış2 plazmada çözülür. Sonuç olarak, denge sola kayar ve COXNUMX basıncı artar.2 akciğerlerde. Aşırı CO2 vücuttan atılır. Sonuç olarak, kanın hidrojen-karbonat sistemi CO ile hızla dengeye gelir.2 alveollerde ve kan plazmasının pH'ının sabitliğini etkili bir şekilde korur. 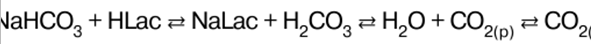 Böylece, asidoz nedeniyle hafif belirgin bir pH kayması ile normal bir kan pH değeri korunur. Kapalı alanlarda, genellikle boğulma (oksijen eksikliği), artan solunum yaşarlar. Bununla birlikte, boğulma oksijen eksikliğinden çok fazla CO2 ile ilişkilidir. Aşırı CO2 atmosferde, Henry yasasına göre, CO'nun ek çözünmesine yol açar2 kan içinde. Bu da kan pH'ında azalmaya, yani asidoza yol açar. Hidrojen-karbonat tampon sistemi, kan pH'ındaki değişikliklere en hızlı şekilde yanıt verir. Asit tampon kapasitesi V'dir.к \u40d XNUMX mmol / l kan plazması ve alkali için tampon kapasitesi çok daha azdır ve yaklaşık olarak V'ye eşittirщ = 1-2 mmol/l kan plazması. 24. Nötralizasyon reaksiyonları Nötralizasyon reaksiyonlarına asit ve bazların etkileşiminin değişim reaksiyonları denir, bunun sonucunda tuz ve su oluşur. Farklı türde nötralizasyon reaksiyonlarını düşünün. 1. Güçlü bir bazın güçlü bir asitle nötralizasyonu: KOH + HNO3 - BİLİM3 + K2O. Böyle bir reaksiyon H için moleküler iyonik denklem+ + OH → H2O ve Gibbs enerjisinin ΔG° negatif değeri, dengenin pratikte su oluşumuna doğru kaydığını gösterir. Nötralizasyon reaksiyonunun yaygın bir durumu, kuvvette (ayrışma derecesi) farklılık gösteren asitler ve bazların etkileşimidir. Tuz hidrolizinin ters reaksiyonu nedeniyle bu reaksiyonlar tamamlanmaz. 2. Zayıf bir asidin güçlü bir bazla nötralizasyonu:  veya moleküler formda:  Bu durumda, nötralizasyon reaksiyonu tersinirdir. Zayıf bir bazın güçlü bir asit ile nötrleştirilmesi reaksiyonu da tersinirdir:  veya moleküler formda: 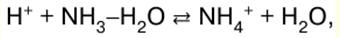 ve ayrıca - zayıf asitli zayıf bir baz: 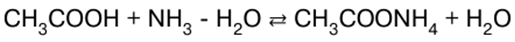 veya moleküler formda:  Bu sistemlerde, su hidrosiyanik asit, amonyak ve asetik asitten çok daha zayıf bir elektrolit olduğundan denge kuvvetli bir şekilde sağa kayar. Nötralizasyon reaksiyonları, nötralizasyon yönteminin temelini oluşturur. Bu yöntem, klinik laboratuvarlarda mide suyunun asitliğini, kan plazmasının tampon kapasitesini belirlemek için kullanılır. Farmakolojide inorganik asitlerin (hidroklorik, sülfürik, borik) ve organik asitlerin (asetik, benzoik, tartarik, sitrik, salisilik) kantitatif analizi için kullanılır. Biyofarmasötik çalışmalarda, asitlerin pKa'sı ve bazların pKa'sı, nötralizasyon yöntemiyle belirlenir, çünkü bu değerlerin değeri, ilaçların biyolojik zarlardan geçme kabiliyetini tahmin edebilir. pK'yi belirlemek için asit-baz titrasyonu kullanılırа amino asitler ve pKа Proteinlerde ayrışan gruplar. İki farklı sıcaklıkta elde edilen protein titrasyon eğrileri, karboksil, imidazol ve diğer grupların sayısını belirlemek için kullanılabilir. Amino asitlerin ve proteinlerin titrasyonu, izoelektrik noktalarının belirlenmesini mümkün kılar. Hidroliz, bir maddenin su ile ayrışmasıdır. Çeşitli sınıflardaki kimyasal bileşikler hidrolize uğrayabilir: proteinler, yağlar, karbonhidratlar, esterler, tuzlar, vb. İnorganik kimyada, en sık olarak tuzların hidrolizi ile karşılaşılır. 25. Tuz hidrolizi tuz hidrolizi - bu, tuzun su molekülleri ile etkileşimi olup, düşük ayrışmalı bileşiklerin oluşumuna yol açar. Hidroliz işlemi, bir protonun bir su molekülünden belirli bir iyona (COXNUMX) geçişinden oluşur.32 + HOH * HCO3+ OH ) veya hidratlı bir metal katyonu dahil olmak üzere belirli bir iyondan bir su molekülüne. Tuzun doğasına bağlı olarak, su ya asit ya da baz olarak hareket eder ve tuz sırasıyla eşlenik baz ya da eşlenik asittir. Tuz tipine bağlı olarak dört çeşit hidroliz mümkündür. 1. Kuvvetli asit ve zayıf bazın oluşturduğu tuzlar:  2. Kuvvetli baz ve zayıf asitten oluşan tuzlar: CH3COONa + HOH → CH3COOH + NaOH. 3. Zayıf asit ve zayıf bazın oluşturduğu tuzlar. Amonyum siyanür reaksiyonla hidrolize edilir: 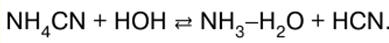 4. Kuvvetli asit ve kuvvetli bazın oluşturduğu tuzlar. NaCl, KNO3 hidrolize uğramaz. Tuz hidrolizinin mekanizması, tuz iyonlarının hidrasyon kabuğu ile polarizasyon etkileşiminden oluşur. Bu etkileşim ne kadar güçlü olursa, hidroliz o kadar yoğun olur. Dikkate alınan tüm hidroliz vakaları, tek asitli bazlar ve tek bazik asitlerden oluşan tuzlarla ilgilidir. Polibazik asitlerin ve poliasit bazların tuzları adım adım hidrolize edilerek asidik ve bazik tuzlar oluşur. Nicel olarak, bir CO dengesi olarak hidroliz, hidroliz derecesi ve hidroliz sabiti ile karakterize edilir. Hidroliz derecesi, hidrolize madde miktarının toplam çözünen miktarına oranı ile ölçülür. Hidroliz derecesi, tuzun doğasına, konsantrasyonuna ve sıcaklığına bağlıdır. Kütle etkisi yasasına göre, çözeltinin seyreltilmesiyle hidroliz derecesi artar. Yani, bir konsantrasyonda Na2CO3 0,001 mol/l, hidroliz derecesi %34'tür. Genel durumda, aşağıdaki düzenlilikler doğrudur. 1. Tuz hidrolizi, artan sıcaklık ve çözeltinin seyreltilmesi ile artmalıdır. 2. Tersinir hidrolizde, Le Chatelier ilkesine göre, işlem asitleştirme (bu tuz güçlü bir asit ve zayıf bir bazdan oluşuyorsa, H iyonları birikir) veya alkalizasyon (tuz aşağıdakilerden oluşuyorsa) ile bastırılmalıdır. zayıf bir asit ve güçlü bir baz, OH iyonları birikir). 3. Reaksiyon küresinden (denge kayması ilkesi) uzaklaştırılan az çözünür veya gazlı ürünlerin oluşumuyla sonuçlanan tuzların hidrolizi geri döndürülemez. Örneğin, Pb(SO) hidrolizi4)2 tamamen PbO çökeltisinin oluşumu nedeniyle ilerler2: Pb(SO4)2 + 2Н2O→PbO2 + 2H2SO4. Hidroliz, birçok inorganik ve organik bileşik sınıfının karakteristiğidir. İnorganik bileşiklerin hidrolizi, toksisitelerini değerlendirmek için önemlidir. Organik bileşiklerin hidrolizi odun, yağ, ester ve diğer şeylerden değerli ürünler elde etmek için kullanılır, ancak hidroliz canlı organizmaların yaşamında özellikle önemli bir rol oynar. 26. Yağış ve çözünme reaksiyonu Elektrolit çözeltisinde meydana gelen değişim reaksiyonları, çökelme ve çözünme reaksiyonlarını içerir. Yağış reaksiyonlarına yağış eşlik eder. Çökeltilerin çözünmesinin eşlik ettiği reaksiyonlara çözünme reaksiyonları denir. Az çözünür bir elektrolit tortusu ve bunun üzerinde doymuş bir çözeltiden oluşan sistemler yaygın olarak kullanılmaktadır. Bu tür sistemlerde doymuş çözelti ile çökelti arasında dinamik bir denge kurulur. Çözünürlüğünün düşük olması nedeniyle, çözeltideki az çözünür elektrolit konsantrasyonu çok düşüktür, bu nedenle çözeltide tamamen ayrıştığı düşünülebilir. Başka bir deyişle, doymuş bir çözeltide, maddenin katı fazı ile çözeltiye geçen iyonlar arasında dinamik denge kurulur. Örneğin, doymuş bir AgCl çözeltisinde aşağıdaki denge gerçekleşir: AgCI(T) → Ag+(P) + Cl(R). Sabit bir değer olarak katı faz AgCl'nin konsantrasyonu, denge sabiti ifadesinden hariç tutulur. Sonuç olarak, denge sabiti yalnızca çözeltideki iyon konsantrasyonlarının çarpımı tarafından belirlenir ve sabit veya çözünürlük ürünü olarak adlandırılır. Genel durumda, Ktn Anm elektroliti için, çözünürlük sabiti iyon konsantrasyonlarının stokiyometrik ürünü ile belirlenir: Кvb= [Ktm+ ]n[Birn]m Bu değer, elektrolitin yabancı maddelerin yokluğunda sabit bir sıcaklıkta çözünürlüğünü karakterize eder. K sabitliğivb çözeltideki tek tek iyonların konsantrasyonlarının sabitliği anlamına gelmez. Bu nedenle, örneğin AgNO ekleyerek doymuş bir AgCl çözeltisindeki Ag iyonlarının konsantrasyonunu artırmak mümkündür.3 , Le Chatelier ilkesine göre denge sola kayar, bu da iyon biriktirme oranında bir artışa yol açar. Bir süre sonra AgCl'nin çözünme hızları ile Ag ve Cl iyonlarının çökelme hızları eşit olacaktır. Yeni kurulan denge, daha önce olduğu gibi, K değeri ile karakterize edilecektir.vb(AgCl), ancak Ag ve Cl iyonlarının denge konsantrasyonları değişecektir. Böylece, K bazındavb elektrolit çökeltilerinin oluşumunu ve çözünmesini iki kurala göre tahmin etmek mümkündür. 1. Elektrolit, çözeltideki iyonlarının konsantrasyonlarının stokiyometrik ürünü, çözünürlük sabitinden büyük olduğunda çökelir. 2. Çözeltideki bileşen iyonlarının konsantrasyonlarının stokiyometrik ürünü, çözünürlük sabitinden daha az olduğunda, elektrolit çökeltisi çözünür. Çöktürme reaksiyonları, farmasötiklerin kantitatif analizinde kullanılan çökeltme yönteminin temelini oluşturur. Çökeltme yöntemi, idrar, mide suyu, kandaki klorürlerin klinik analizinde, sıhhi ve hijyenik uygulamada - içme suyunun analizinde kullanılır. Bilim adamları, doğal element bileşiklerinin sudaki farklı çözünürlüklerinin, canlı organizmalardaki içerikleri üzerinde büyük etkisi olduğuna inanıyor. Bileşiklerin sudaki çözünürlüğü ile bazı elementlerin iyonlarının toksik etkisi arasında yakın bir ilişki vardır. Örneğin, Al'ın tanıtımı3 + zayıf çözünür alüminyum fosfat AlPO4 oluşumu nedeniyle vücuda 27. Redoks reaksiyonları İnorganik kimyanın temel kavramlarından biri oksidasyon durumu (CO) kavramıdır. Bir bileşikteki bir elementin oksidasyon durumu, değerlik elektronlarının daha yüksek bağıl elektronegatifliğe (RER) sahip atomlara geçtiği ve bileşik moleküldeki tüm bağların iyonik olduğu varsayımından hesaplanan, element atomunun resmi yüküdür. E elementinin oksidasyon durumu, sayıdan önce "+" veya "-" işareti ile element sembolünün üst kısmında gösterilir. Bir çözeltide veya kristallerde fiilen bulunan iyonların yükseltgenme derecesi yük numaralarıyla çakışır ve benzer şekilde sayıdan sonra "+" veya "-" işaretiyle gösterilir, örneğin Cl,CA2+. Stok yöntemi ayrıca elementin sembolünden sonra Roma rakamlarıyla oksidasyon derecesini belirtmek için kullanılır: Mn (VII), Fe (III). Bir moleküldeki atomların oksidasyon durumunun işareti sorusu, molekülü oluşturan birbirine bağlı atomların elektronegatifliklerinin karşılaştırılmasıyla çözülür. Bu durumda, daha düşük elektronegatifliğe sahip bir atom, pozitif bir oksidasyon durumuna ve daha yüksek bir elektronegatifliğe sahip - negatif bir duruma sahiptir. Oksidasyon durumunun, elementin değerliği ile tanımlanamayacağına dikkat edilmelidir. Belirli bir atomu diğer atomlara bağlayan kimyasal bağların sayısı olarak tanımlanan değerlik, sıfır olamaz ve "+" veya "-" işaretine sahip değildir. Oksidasyon durumu hem pozitif hem de negatif değerlerin yanı sıra sıfır ve hatta kesirli değerlere sahip olabilir. Örneğin, bir CO molekülünde2 C'nin oksidasyon durumu +4'tür ve CH molekülünde4 C'nin oksidasyon durumu 4'tür. Her iki bileşikte de karbon4a'nın değeri IV'tür. Yukarıdaki dezavantajlara rağmen, kimyasal bileşiklerin sınıflandırılmasında ve redoks reaksiyonları için denklemlerin formülasyonunda oksidasyon derecesi kavramının kullanılması uygundur. Bir element oksitlendiğinde oksidasyon durumu artar, diğer bir deyişle reaksiyon sırasında indirgeyici ajan oksidasyon durumunu arttırır. Aksine, element indirgendiğinde oksidasyon durumu azalır, yani reaksiyon sırasında oksitleyici ajan oksidasyon durumunu azaltır. Bu nedenle, aşağıdaki redoks reaksiyonları formülasyonunu vermek mümkündür: redoks reaksiyonları, reaksiyona giren maddeleri oluşturan elementlerin atomlarının oksidasyon durumundaki bir değişiklikle meydana gelen reaksiyonlardır. 28. Oksitleyici ve indirgeyici maddeler Ürünleri ve redoks reaksiyonlarının yönünü tahmin etmek için, tipik oksitleyici ajanların, atomları büyük EER> 3,0 (VIA ve VIIA gruplarının elementleri) olan basit maddeler olduğunu hatırlamakta fayda vardır. Bunlardan en güçlü oksitleyici ajanlar flor (OEO = 4,0), oksijen (OEO = 3,0), klor (OEO = 3,5). Önemli oksidanlar arasında PbO bulunur2 KMnO4 , Ca(SO4)2 , İLE2cr2O7 , HCIO, HCIO3, KSIO4, NaBio3, H2SO4(son), H.N.O.3(son) Na2O2 , (SS4)2S2O8 , KSIO3 , H2O2 ve daha yüksek veya daha yüksek CO atomları içeren diğer maddeler. Tipik indirgeyici ajanlar, atomları küçük bir EER < 1,5 olan basit maddeleri içerir (IA ve IIA gruplarının metalleri ve diğer bazı metaller). Önemli indirgeyici ajanlar H içerir.2S,NH3, HI, KI, SnCI2 , FeSO4 ,C,H2 ,CO,H2SO3 , Kr2(SO4)3 , CuCl, Na2S2O3 ve düşük CO atomları içeren diğer maddeler. Sırasıyla maksimum ve minimum oksidasyon durumlarında atom içeren maddeler yalnızca oksitleyici ajanlar olabilir, örneğin K2Cr2O7 , KMPO4 , PbO2 , HCIO4 veya sadece NH gibi indirgeyici ajanlar3 , H2Merhaba. Ara oksidasyon durumlarında atom içeren maddeler, oksidasyon durumunu hem yükseltebilir hem de azaltabilir, yani hem indirgeyici maddeler (onlardan daha aktif bir oksitleyici maddenin etkisi altında) hem de oksitleyici maddeler (daha fazla bir maddenin etkisi altında) olabilirler. onlardan daha aktif, indirgeyici ajan). Bu tür maddeler redoks ikiliği sergiler. Redoks reaksiyonlarının denklemlerini derlerken iki yöntem kullanılabilir: elektron dengesi yöntemi ve iyon-elektron yöntemi (yarı reaksiyon yöntemi). Çözeltilerdeki redoks süreçleri hakkında daha doğru bir fikir iyon-elektron yöntemiyle verilir. Bu yöntem sayesinde çözeltide fiilen var olan iyon ve moleküllerin uğradığı değişimler tahmin edilir. Reaksiyon ürünlerini tahmin etmenin yanı sıra, elektroliz sırasında ve galvanik hücrelerde meydana gelen redoks proseslerini anlamak için iyonik yarı reaksiyon denklemleri gereklidir. Bu yöntem, sürecin bir katılımcısı olarak çevrenin rolünü yansıtır. Ve son olarak, bu yöntemi kullanırken, birçoğu redoks reaksiyonlarının denkleminin derlenmesiyle elde edildiğinden, oluşan tüm maddeleri önceden bilmek gerekli değildir. Unutulmamalıdır ki, yarı reaksiyonlar redoks reaksiyonları sırasında meydana gelen gerçek süreçleri yansıtsa da, redoks reaksiyonlarının gerçek aşamaları (mekanizması) ile tanımlanamazlar. Redoks reaksiyonlarının doğasını ve yönünü birçok faktör etkiler: reaktanların doğası, ortamın reaksiyonu, konsantrasyon, sıcaklık ve katalizörler. Negatif bir değerin, reaksiyonun belirli bir yöndeki gerçek seyri hakkında her zaman kesin bir karara yol açmadığı akılda tutulmalıdır, çünkü ayrıca kinetik faktörü de hesaba katmak gerekir. 29. Redoks işlemlerinin biyolojik önemi Redoks reaksiyonları, elektronların bir molekül veya iyondan diğerine transferinin eşlik ettiği kimyasal süreçlerdir. Redoks reaksiyonlarında birbiriyle ilişkili iki süreç meydana gelir: oksidasyon ve indirgeme. Oksidasyon elektron kaybetme sürecidir. Kurtarma, elektron ekleme işlemidir. Atomları veya iyonları elektron veren maddelere indirgeyici maddeler denir. Atomları veya iyonları elektron ekleyen (veya ortak bir elektron çiftini kendilerine çeken) maddelere oksitleyici ajanlar denir. Çinkonun CuSO ile reaksiyonunda4 Cu2 + elektron ekle: kendileri2+ + 2e־ - Si0 . Çinko atomları elektron bağışlar: Zn0 -Zn2 + 2e־. Buna göre, CuSO4 - oksitleyici ajan, Zn - indirgeyici ajan. Hayvan organizmalarındaki önemli süreçler, substrat maddelerinin enzimatik oksidasyonunun reaksiyonlarıdır: karbonhidratlar, yağlar, amino asitler. Bu işlemlerin bir sonucu olarak, organizmalar büyük miktarda enerji alırlar. Erişkin bir erkeğin toplam enerji ihtiyacının yaklaşık %90'ı, karbonhidrat ve yağların oksidasyonu sırasında dokularda üretilen enerji ile karşılanır. Enerjinin geri kalanı - ~%10, amino asitlerin oksidatif parçalanmasıyla sağlanır. Biyolojik oksidasyon, çok sayıda enzimin katılımıyla karmaşık mekanizmalar yoluyla ilerler. Mitokondride oksidasyon, organik substratlardan elektron transferinin bir sonucu olarak meydana gelir. Elektron taşıyıcıları olarak mitokondrinin solunum zinciri, elektronları taşımak üzere tasarlanmış çeşitli fonksiyonel grupları içeren çeşitli proteinleri içerir. Zincir boyunca bir ara maddeden diğerine hareket ederken, elektronlar serbest enerjilerini kaybederler. Solunum zinciri yoluyla oksijene aktarılan her elektron çifti için 3 ATP molekülü sentezlenir. 2 elektronun oksijene transferi sırasında açığa çıkan serbest enerji 220 kJ/mol'dür. 1 ATP molekülünün standart koşullar altında sentezi 30,5 kJ tüketir. Bundan, bir çift elektronun transferi sırasında salınan serbest enerjinin oldukça önemli bir kısmının ATP moleküllerinde depolandığı açıktır. Bu verilerden, ilk indirgeyici ajandan oksijene çok aşamalı elektron transferinin rolü de netleşir. Bir çift elektronun oksijene transferi sırasında açığa çıkan büyük enerji (220 kJ), oksidasyonun bireysel aşamalarına karşılık gelen birkaç bölüme ayrılır. Bu tür üç aşamada, salınan enerji miktarı yaklaşık olarak 1 ATP molekülünün sentezi için gereken enerjiye karşılık gelir. Redoks reaksiyonları, klinik analizde Ca iyonlarını, ürik asit, katalaz ve peroksidaz enzimlerini, kandaki şekeri belirlemek için ve sıhhi ve hijyenik analizlerde suyun oksitlenebilirliğini, aktif klor içeriğini belirlemek için kullanılan oksidimetri yöntemlerinin temelini oluşturur. ağartıcıda, evde ve içme suyunda kalan klor. 30. Kimyasal bağ ve deneysel özellikleri Modern bir atom modelinin geliştirilmesi ve bireysel atomların özelliklerinin buna dayalı olarak tahmin edilmesi, kuantum mekaniğinin çok önemli bir başarısıdır. Bununla birlikte, karasal koşullar altında izole edilmiş atomlar nadiren bulunur. Çevremizdeki cansız ve canlı doğanın bedenleri çeşitli moleküllerden oluşur. A. M. Butlerov (1828-1886) organik maddelerin kimyasal yapısı teorisini yarattı (1861). O zamandan beri, "değerlik" ve "kimyasal bağ" kavramları yavaş yavaş kimyaya girmeye başladı. Değerlik, bir atomun bir molekül oluşturmak için belirli sayıda başka atomu bağlama yeteneğidir. Değerlik, öğe sembolünün yanındaki çizgilerle gösterilir. Hidrojen (H) tek değerlidir, oksijen (0= ) iki değerlidir. Değerlik çizgilerinin sayısı, belirli bir atomun diğer atomlarla oluşturabileceği kimyasal bağların sayısını belirler. Kimyasal bir bağ, elektronlar ve çekirdekler arasında, atomların bir molekül halinde bir araya gelmesine yol açan bir dizi etkileşimdir. Kimyasal bir bağın özellikleri çeşitli yöntemlerle incelenir. Kimyasal yöntemler yardımıyla atomların bağ sayısı (değerlik) ve reaktiflikleri belirlenir. Fiziksel yöntemler kullanılarak kimyasal bağların uzunluğu, kuvveti, yönü ve polaritesi belirlenir. Kimyasal bağ uzunluğu rс bağlı atomların çekirdekleri arasındaki mesafe ile ölçülen değer olarak adlandırılır. Bir kimyasal bağ uzunluğu birimi olarak gс pikometre kullanımı uygun (pm): 1 pm = 1012 m Kimyasal bağ gücü Eс - entalpi ΔЕ ile ölçülen değerс bağlantı oluşumu. Bir kimyasal bağ kuvveti birimi olarak Eс kJ/mol kullanılır. Kimyasal bağ yönelimi aс - belirli bir atomun molekülün komşu atomlarıyla bağlarının yönleri arasındaki açı ile ölçülen değer. ac açısına değerlik açısı denir. Bağ açısı birimi aс - derece. Kimyasal bağ polaritesi μс - bu bağlantının elektrik momenti ile ölçülen değer. Mutlak değer olarak eşit ve zıt işaretli +q ve ־q iki elektrik yükü için elektrik momenti, μ = qr'ye eşittir; burada r, yükler arasındaki mesafedir. Bu iki yük bir elektrik dipolü oluşturur. Farklı elektronegatifliğe (EEO) sahip 2 atom bağlandığında kimyasal bir bağ polarize olur. Sonuç olarak, büyük bir EER'ye sahip bir atomda aşırı bir negatif yük δ ortaya çıkar ve daha küçük bir EER'ye sahip başka bir atomda aşırı bir pozitif yük +δ ortaya çıkar. Bağın polaritesi aşağıdaki formülle hesaplanır: μс = δrс. Bir kimyasal bağın polaritesini ölçmek için bir birim olarak, sistem dışı Debye birimini (D) - 1 D = 3,3 x 1030 C/m kullanmak uygundur. Su molekülündeki O-H bağının polaritesi μo = 1,5D. Kimyasal bağın incelenmesi, çoğu durumda aynı kimyasal bağın farklı bileşiklerdeki uzunluğunun, gücünün, yöneliminin, polaritesinin yaklaşık olarak aynı değerlere sahip olduğunu göstermiştir. Dolayısıyla, atomlar arasında belirli bir bağın oluşumuna yol açan etkileşimlerin farklı moleküllerde aynı nitelikte olduğu sonucu çıkar. Kuantum mekanik kimyasal bağ teorileri, bu gerçek için bir açıklama sağlar. 31. Hidrojen bağı. Moleküller arası ve moleküller arası hidrojen bağı Moleküllerdeki kimyasal bağlar genellikle çok güçlüdür, enerjileri 100-150 kJ/mol aralığındadır. Ayrıca gücü 10-40 kJ/mol olan hidrojen bağları da vardır. Bu bağların uzunluğu sırasıyla 270-230 pm'dir. E atomları arasındaki hidrojen bağıА ve EВ E'ye bağlı bir hidrojen atomu tarafından gerçekleştirilen etkileşime denir.А veya EВ Kimyasal bağ. Genel durumda bir hidrojen bağının görüntüsü şu şekildedir: ЭА-N...Eв.. Açıktır ki, hidrojen bağı, oluşumunda 3 atom yer aldığından, üç merkezlidir. Böyle bir bağın oluşması için E atomlarının olması gerekir.А ve EВ yüksek elektronegatifliğe sahiptir. Bunlar en negatif elementlerin atomlarıdır: nitrojen (REO = 3,0), oksijen (REO = 3,5), flor (REO = 4,0) ve klor (REO = 3,0). ls-AO hidrojen ve iki 2pAO E atomunun bir kombinasyonunun bir sonucu olarak bir hidrojen bağı oluşur.А ve EВ; 2 rorbital bir düz çizgi boyunca yönlendirilir. Bu nedenle hidrojen bağı lineerdir. Hidrojen bağı denir: 1) molekül içi, eğer E atomlarıА ve EВ bu bağla bağlanan aynı moleküle aittir; 2) moleküller arası, eğer atomlar EА ve EВ farklı moleküllerde bulunur. Molekül içi hidrojen bağları, örneğin polimerik protein moleküllerinin sarmal yapısını belirledikleri için önemli bir biyolojik rol oynar. Proteinlerde bunlar amino asit kalıntıları arasındaki N-H ... O bağlarıdır. Aynı derecede önemli olan moleküller arası hidrojen bağlarıdır. Onların yardımıyla nükleik asit zincirleri birbirine bağlanarak çift sarmal oluşturur. Nükleik bazlar arasında iki tür bağ vardır - NHN ve N-H-O. Moleküllerin termal hareketinin ortalama kinetik enerjisi 3/2RT mertebesindedir. 37°C'lik (310°K) bir insan vücut sıcaklığında, bu yaklaşık 4 kJ/mol'dür. Hidrojen bağlarının gücü 10-40 kJ/mol aralığındadır, bu nedenle çevredeki moleküllerin sürekli etkilerine dayanacak ve polimerik biyolojik yapıların şeklinin sabitliğini sağlayacak kadar güçlüdürler. Aynı zamanda aktif moleküllerin etkisi ile hidrojen bağları periyodik olarak kırılır, daha sonra tekrar eski haline getirilerek çeşitli yaşam süreçlerinin akışı sağlanır. Dikkate alınan örnekler, MO LCAO yönteminin VS yönteminden daha geniş bir uygulama yelpazesini açıkça göstermektedir. Bununla birlikte, VS yöntemi, karmaşık bileşikler de dahil olmak üzere birçok maddenin özelliklerini ve yapısını tahmin etmek için başarıyla kullanılabilir. 32. Çevredeki ve insan vücudundaki makro ve mikro elementler İnsan vücudunda bulunan kimyasal elementlerin çeşitli sınıflandırmaları vardır. Böylece, V. I. Vernadsky, canlı organizmalardaki ortalama içeriğe (kütle oranı w,%) bağlı olarak, elementleri on günlük sisteme göre böldü. Bu sınıflandırmaya göre canlı organizmalarda bulunan elementler üç gruba ayrılır: makro, mikro ve ultramikro elementler. makro besin Bunlar vücuttaki içeriği 10'dan fazla olan elementlerdir.2%. Bunlar oksijen, karbon, hidrojen, azot, fosfor, kükürt, kalsiyum, magnezyum, sodyum ve klordur. Eser Öğeleri Bunlar vücuttaki içeriği 10 aralığında olan elementlerdir.3 10 için5%. Bunlara iyot, bakır, arsenik, flor, brom, stronsiyum, baryum, kobalt dahildir. ultramikro elementler Bunlar vücuttaki içeriği 10'un altında olan elementlerdir.5%. Bunlara cıva, altın, uranyum, toryum, radyum vb. dahildir. Şu anda, ultramikro elementler mikro elementlerle bir grupta birleştirilir. Bu sınıflandırma, yalnızca canlı organizmalardaki elementlerin içeriğini yansıtır, ancak şu veya bu elementin biyolojik rolünü ve fizyolojik önemini göstermez. V. V. Kovalsky, yaşam için önemlerine göre kimyasal elementleri üç gruba ayırdı. Hayati (yeri doldurulamaz) unsurlar İnsan vücudunda sürekli bulunurlar, enzimlerin, hormonların ve vitaminlerin bir parçasıdırlar: H, O, Ca, N, K, P, Na, S, Mg, d, C, I, Mn, Cu, Co, Fe, Zn, Mo, V. Eksiklikleri normal insan yaşamının bozulmasına yol açar. kirlilik elementleri Bu elementler hayvanların ve insanların vücudunda sürekli olarak bulunur: Ga, Sb, Sr, Br, F, B, Be, Li, Si, Sn, Cs, Al, Ba, Ge, As, Rb, Pb, Ra, Bi, Cd, Cr, Ni, Ti, Ag, Th, Hg, U, Se. Biyolojik rolleri çok az anlaşılmış veya bilinmemektedir. kirlilik elementleri Sc, Tl, In, La, Pr, Sm, W, Re, Tb vb. İnsanlarda ve hayvanlarda bulunur. Sayısı ve biyolojik rolü ile ilgili veriler henüz netlik kazanmamıştır. Çeşitli hücre ve organizmaların yapımı ve yaşamsal faaliyetleri için gerekli olan elementlere biyojenik elementler denir. İz elementlerin çok düşük konsantrasyonlarını belirlemenin ve biyolojik işlevlerini belirlemenin zorluğundan dolayı tüm biyojenik elementleri doğru bir şekilde listelemek hala imkansızdır. 24 element için biyojenlik güvenilir bir şekilde belirlendi. Bunlar birinci grubun unsurları ve ikinci grubun bazı unsurlarıdır (Kowalski'ye göre). 33. İnsan vücudundaki en önemli biyojenik elementlerin topografyası İnsan organları, çeşitli kimyasal elementleri kendi içlerinde farklı şekilde konsantre eder, yani mikro ve makro elementler farklı organlar ve dokular arasında eşit olmayan bir şekilde dağılır. Çoğu eser element karaciğer, kemik ve kas dokularında birikir. Bu dokular birçok eser elementin ana depolarıdır (depolarıdır). Elementler, belirli organlar için belirli bir afinite gösterebilir ve bunlarda yüksek konsantrasyonlarda bulunabilir. Çinkonun pankreasta, iyotun - tiroid bezinde, florin - diş minesinde, alüminyum, arsenik, vanadyumun saç ve tırnaklarda, kadmiyum, cıva, molibdenin - böbreklerde, kalayda - yoğunlaştığı iyi bilinmektedir. bağırsak dokuları, stronsiyum - prostat bezinde, kemik dokusunda, baryum - gözün pigmentli retinasında, brom, manganez, krom - hipofiz bezinde vb. Organizmalarda eser elementler bağlı halde ve serbest iyonik formlarda olabilir. Beyin dokularındaki silisyum, alüminyum, bakır ve titanyumun proteinlerle kompleks halinde, manganezin ise iyonik formda olduğu bilinmektedir. Hidrojen ve oksijen makro besinlerdir. Bir yetişkinin vücudunda ortalama olarak yaklaşık% 65 oranında bulunan suyun bir parçasıdırlar. Su, insan organları, dokuları ve biyolojik sıvılar üzerinde eşit olmayan bir şekilde dağılır. Yani, mide sıvısında, tükürükte, kan plazmasında, lenfte, su% 89,5 ila% 90, idrarda, beynin gri maddesinde, böbreklerde -% 80, beynin beyaz maddesinde, karaciğerde, deride, omurilikte, kaslar, akciğerler, kalp - %70-80. Suyun en az %40'ı iskelette bulunur. Makro besinler - karbon, hidrojen, oksijen, nitrojen, kükürt, fosfor - proteinlerin, nükleik asitlerin ve vücudun diğer biyolojik olarak aktif bileşiklerinin bir parçasıdır. Proteinlerdeki karbon içeriği %51-55, oksijen - %22-24, nitrojen - %15-18, hidrojen - %6,5-7, kükürt - %0,3-2,5, fosfor - yaklaşık %0,5'tir. Karbon, hidrojen ve oksijen de hayvan dokularında içeriği düşük olan - yaklaşık% 2 olan karbonhidratların bir parçasıdır. Bu elementler lipitlerin (yağların) bir parçasıdır. Ek olarak, fosfolipidlerin bileşimi, fosfat grupları şeklinde fosfor içerir. Lipitler büyük ölçüde beyinde (%12), ardından karaciğerde (%5), sütte (%2-3) ve kan serumunda (%0,6) yoğunlaşır. Ancak fosforun ana kısmı (600 g) kemik dokusunda bulunur. Bu, insan vücudundaki tüm fosfor kütlesinin% 85'idir. Fosfor ayrıca kalsiyum, klor, flor ile birlikte hidroksil, klor, genel formül Ca'nın florapatitleri şeklinde dahil edildiği dişlerin sert dokularında konsantredir.5 (PO4)3X, burada X = OH, CI, F, sırasıyla. Kalsiyum ağırlıklı olarak kemikte olduğu kadar diş dokularında da konsantredir. Sodyum ve klor esas olarak hücre dışı sıvılarda bulunurken, potasyum ve magnezyum hücre içi sıvılarda bulunur. Florürler formunda, sodyum ve potasyum kemik ve diş dokularının bir parçasıdır. Mg Fosfat Olarak Magnezyum3 (PO4)2 dişin sert dokularında bulunur. Hormonlar, vücutta belirli bir makro ve mikro element içeriğinin korunmasında rol oynar. 34. Kimyasal elementlerin vücuttaki biyolojik rolü Kimyasal elementlerin insan vücudundaki biyolojik rolü son derece çeşitlidir. Makrobesinlerin ana işlevi, dokular oluşturmak, sabit bir ozmotik basınç, iyonik ve asit-baz bileşimini korumaktır. Enzimlerin, hormonların, vitaminlerin, biyolojik olarak aktif maddelerin kompleks oluşturucu veya aktivatör olarak bir parçası olan iz elementler, metabolizma, üreme süreçleri, doku solunumu ve toksik maddelerin nötralizasyonunda rol oynar. İz elementler, kan damarlarının ve dokuların hematopoez, oksidasyon, redüksiyon, geçirgenlik süreçlerini aktif olarak etkiler. Makro ve mikro elementler - kalsiyum, fosfor, flor, iyot, alüminyum, silikon - kemik ve diş dokularının oluşumunu belirler. Çeşitli eser elementlerin eksikliği veya aşırı birikimi ile ilişkili birçok hastalık tanımlanmıştır. Flor eksikliği diş çürüklerine, iyot eksikliği - endemik guatr, fazla molibden - endemik guta neden olur. Bu tür modeller, insan vücudunda - kimyasal homeostaz - optimal biyojenik element konsantrasyonlarının dengesinin korunması gerçeğiyle bağlantılıdır. Element eksikliği veya fazlalığı nedeniyle bu dengenin ihlali çeşitli hastalıklara yol açabilir. Altı ana makro besine ek olarak - karbonhidratları, yağları, proteinleri ve nükleik asitleri oluşturan organojenler (karbon, hidrojen, nitrojen, oksijen, kükürt ve fosfor), inorganik makro besinler - kalsiyum, klor, magnezyum, potasyum, sodyum - ve iz elementler - bakır, flor, iyot, demir, molibden, çinko ve ayrıca muhtemelen (hayvanlar için kanıtlanmıştır), - selenyum, arsenik, krom, nikel, silikon, kalay, vanadyum. İnsan vücudundaki mikro elementlerin içeriğinin ve oranının analizi de adli tıbbi muayenede kullanılır. Örneğin alkol zehirlenmesi durumunda, etil alkolün etkisi altında karaciğerdeki kalsiyum miktarı artar, sodyum ve potasyum azalır. Aynı zamanda kalp ve böbreklerde ise tam tersine kalsiyum içeriği azalır. Diyette demir, bakır, flor, çinko, iyot, kalsiyum, fosfor, magnezyum ve diğer bazı elementlerin eksikliği insan sağlığı için ciddi sonuçlara yol açmaktadır. Bununla birlikte, kimyasal homeostazı bozduğu için, sadece bir eksikliğin değil, aynı zamanda fazla biyojenik elementlerin vücuda zararlı olduğu unutulmamalıdır. İhmal edilebilir miktarlarda hayati önem taşıyan mineral bileşenler, daha yüksek konsantrasyonlarda toksik hale gelir. Bir dizi element (gümüş, cıva, kurşun, kadmiyum vb.) Toksik olarak kabul edilir, çünkü eser miktarlarda bile vücuda girmeleri ciddi patolojik olaylara yol açar. Çeşitli elementler ve bunların bileşikleri ilaç olarak yaygın olarak kullanılmaktadır. Böylece, kimyasal elementlerin biyolojik rolünün incelenmesi, bu elementlerin değişimi ile diğer biyolojik olarak aktif maddeler (enzimler, hormonlar, vitaminler) arasındaki ilişkinin aydınlatılması, yeni ilaçların yaratılmasına ve optimal dozaj rejimlerinin geliştirilmesine katkıda bulunur. hem terapötik hem de profilaktik amaçlar için. 35. S-elementleri ve bileşikleri Su, dünyadaki en önemli ve yaygın hidrojen bileşiklerinden biridir. Su alanı, dünya yüzeyinin neredeyse% 75'ini kaplar. Bir yetişkinin vücudu ortalama olarak% 65-67 su, fetüs (4 ay) -% 94, yenidoğanlarda -% 74 içerir. Vücuttaki tüm kimyasal reaksiyonlar sadece su ortamında meydana gelir. Su olmadan hayat imkansızdır. Damıtılmış su bir farmakope preparatıdır. Tıbbi uygulamada başka bir hidrojen bileşiği kullanılır - hidrojen peroksit H2 02. Bu bileşik, metabolizmanın önemli bir yan ürünüdür. Hidrojen peroksit renksiz, şeffaf bir sıvıdır. Deri ve mukoz membranlarla temasında yanmaya neden olur. molekül H2О2 kutupsal. Oksijen atomlarında yalnız elektron çiftlerinin varlığı, ligandlar - elektron alıcıları ile hidrojen peroksitin verici-alıcı bağlarını oluşturmayı mümkün kılar. H oksijenin oksidasyon durumu2О2 1'e eşittir, yani sudaki oksijenin oksidasyon durumu (2) ile elementel oksijen O arasındaki bir ara değere sahiptir.2 . Bundan, hidrojen peroksitin hem oksitleyici bir ajanın özelliklerini hem de bir indirgeyici ajanın özelliklerini (redoks ikiliği) sergileyebileceği sonucu çıkar. Bununla birlikte, standart redoks yarı reaksiyon potansiyellerine bakılırsa, hidrojen peroksit daha çok oksitleyici özelliklerle karakterize edilir. Saf hidrojen peroksit termodinamik olarak kararsızdır ve ayakta dururken patlayıcı olarak su ve oksijene ayrışır ve büyük miktarda ısı açığa çıkarır. Sulu hidrojen peroksit çözeltileri daha kararlıdır, serin bir yerde uzun süre saklanabilirler. Hidrojen peroksit genellikle% 30 sulu çözelti - perhidrol şeklinde satılır. Hidrojen peroksitin birlikte bozunma süreci, ağır metal tuzlarının mevcudiyetinde önemli ölçüde hızlanır. Hidrojen peroksitin metal iyon katalizli ayrışması, en önemlileri hidroksit HXNUMX ve hidroperoksit olan radikallerin oluşumuna yol açabilir. Toksisite şu gerçeğinden kaynaklanmaktadır:2О2 ve O2 hücre zarlarının lipid tabakası ile etkileşir ve onlara zarar verir. Tıbbi uygulamada, hidrojen peroksit esas olarak harici bir bakterisidal ajan olarak kullanılır. Eylem H2О2 hidrojen peroksitin oksitleyici gücüne ve indirgeme ürünü olan suyun zararsızlığına dayanmaktadır. Yaraların tedavisinde salınan oksijen ikili bir rol oynar: 1) antimikrobiyal, koku giderici ve pigment giderici etkiye sahiptir, mikrobiyal cisimleri öldürür; 2) doku çürümesi parçacıklarının askıya alınmış bir duruma geçişine ve yaraların temizlenmesine katkıda bulunan köpük oluşturur. Bir farmakope preparasyonu olarak, saçları ağartmak için% 3'lük bir sulu hidrojen peroksit çözeltisi kullanılır,% 6'lık bir hidrojen peroksit çözeltisi kullanılır. % 30'luk bir çözelti halinde, liken planusun siğilli formunun tedavisinde ve genç siğillerin giderilmesinde hidrojen peroksit kullanılır. 36. IA grubunun (lityum, rubidyum, sezyum, fransiyum) s-elementlerinin biyolojik rolü İnsan vücudundaki içeriğine göre sodyum (%0,08) ve potasyum (%0,23) makrobesinler, geri kalan alkali metaller ise lityumdur (104%), rubidyum (105%), sezyum (104%) - elementleri izlemek için. lityum İnsan vücudundaki lityum içeriği yaklaşık 70 mg (10 mmol) - %104'tür. Yüksek hayvanlardaki lityum bileşikleri karaciğer, böbrekler, dalak, akciğerler, kan ve sütte yoğunlaşmıştır. Maksimum miktarda lityum insan kaslarında bulunur. Bir eser element olarak lityumun biyolojik rolü henüz tam olarak aydınlatılamamıştır. Hücre zarları düzeyinde, Li iyonlarının (yeterli bir konsantrasyonda) hücrelere nüfuz ederken sodyum iyonlarıyla rekabet ettiği kanıtlanmıştır. Açıktır ki, hücrelerde Na iyonlarının Li iyonları ile yer değiştirmesi, lityum bileşiklerinin daha büyük bir kovalansı ile ilişkilidir, bunun bir sonucu olarak, fosfolipitlerde daha iyi çözünürler. Bazı lityum bileşiklerinin manik depresyonlu hastalar üzerinde olumlu etkisi olduğu tespit edilmiştir. Gastrointestinal sistemden emilen Li iyonları kanda birikir. Li iyonlarının konsantrasyonu 0,6 mmol / l ve üstüne ulaştığında, duygusal gerginlikte bir azalma ve manik heyecanın zayıflaması olur. Aynı zamanda, kan plazmasındaki Li iyonlarının içeriği sıkı bir şekilde kontrol edilmelidir. Li iyonlarının konsantrasyonunun 1,6 mmol/l'yi aştığı durumlarda, olumsuz olaylar mümkündür. rubidyum ve sezyum İnsan vücudundaki rubidyum içeriğine göre (105%) ve sezyum (104%) eser elementlere aittir. Vücutta sürekli olarak bulunurlar, ancak biyolojik rolleri henüz açıklığa kavuşturulmamıştır. Tam bir potasyum analoğu olan rubidyum, hücre içi sıvıda da birikir ve çeşitli işlemlerde eşdeğer miktarda potasyumun yerini alabilir. Radyoaktif İzotoplar 13rC'ler ve 87Rb, kötü huylu tümörlerin radyoterapisinde ve ayrıca potasyum metabolizması çalışmasında kullanılır. Hızlı bozulmaları nedeniyle, uzun vadeli zararlı etkilerden korkmadan vücuda bile girebilirler. Fransa Bu, yapay yollarla elde edilen radyoaktif bir kimyasal elementtir. Fransiyumun, gelişimlerinin en erken aşamalarında tümörlerde seçici olarak birikebildiğine dair kanıtlar vardır. Bu gözlemler kanser tanısında faydalı olabilir. Dolayısıyla IA grubunun elementlerinden Li, Rb, Cs fizyolojik olarak aktif iken Na ve K vitaldir. Atomlarının elektronik yapısının benzerliğinden dolayı Li ve Na'nın fizikokimyasal özelliklerinin yakınlığı, katyonların biyolojik eyleminde de kendini gösterir (hücre dışı sıvıda birikim, değiştirilebilirlik). Büyük periyotlardaki elementlerin katyonlarının biyolojik etkisinin benzer bir doğası - K+, Rb+, C'ler+ (hücre içi sıvıda birikim, değişebilirlik) ayrıca elektronik yapılarının ve fizikokimyasal özelliklerinin benzerliğinden kaynaklanmaktadır. Bu, lityum ve rubidyum tuzları ile zehirlenme durumunda sodyum ve potasyum preparatlarının kullanımının temelidir. 37. IA grubunun (sodyum, potasyum) s-elementlerinin biyolojik rolü 70 kg ağırlığındaki bir insan vücudundaki sodyum içeriği yaklaşık 60 g (2610 mmol) - %0,08'dir. Bu miktarın %44'ü hücre dışı sıvıda, %9'u hücre içi sıvıda bulunur. Sodyumun geri kalanı, Na iyonunun vücutta depolandığı yer olan kemik dokusundadır. Kemik dokusunda bulunan sodyumun yaklaşık% 40'ı metabolik süreçlerde yer alır ve bu nedenle iskelet, hücre dışı sıvıda sabit bir Na iyonu konsantrasyonunun korunmasına yardımcı olan bir Na iyonu vericisi veya alıcısıdır. Sodyum ana hücre dışı iyondur. İnsan vücudunda sodyum, başta klorür, fosfat ve hidrojen karbonat olmak üzere çözünebilir tuzları halindedir. Sodyum vücutta dağılır: kan serumunda, beyin omurilik sıvısında, göz sıvısında, sindirim sularında, safrada, böbreklerde, deride, kemik dokusunda, akciğerlerde ve beyinde. Na iyonları, insan vücudunun iç ortamının sabitliğini sağlamada önemli bir rol oynar, biyoakışkanın (osmotik homeostaz) sabit bir ozmotik basıncının korunmasında rol oynar. Na iyonları su metabolizmasının düzenlenmesinde yer alır ve enzimlerin işleyişini etkiler. K, Mg, Ca, Cl iyonları ile birlikte, Na iyonu sinir uyarılarının iletilmesinde rol oynar ve kas hücrelerinin normal uyarılabilirliğini korur. Vücuttaki sodyum içeriği değiştiğinde, sinir, kardiyovasküler ve diğer sistemlerde, düz ve iskelet kaslarında işlev bozuklukları meydana gelir. Sodyum klorür NaCl, mide suyu için ana hidroklorik asit kaynağıdır. Sodyum insan vücuduna esas olarak sofra tuzu şeklinde girer. Vücudun gerçek günlük sodyum ihtiyacı 1 g'dır, ancak bu elementin ortalama alımı 4-7 g'a ulaşır.Sürekli aşırı NaCl alımı hipertansiyona katkıda bulunur. Alkalilerin mikrobiyal hücreler üzerindeki etkisi altında, hücresel proteinlerin çökelmesi ve bunun sonucunda mikroorganizmaların ölümü meydana gelir. Sodyum sülfat (Glauber tuzu) Na2SO4 × 10 saat2O müshil olarak kullanılır. Sodyum tetraborat Na2B4О7 × 10 saat2O harici olarak durulama, duş alma, yağlama için antiseptik olarak kullanılır. % 10'luk bir çözelti formundaki sodyum hidroksit, kobalt-krom alaşımından döküm protezlerin üretiminde refrakter modellerin dökümü için ortopedik uygulamada kullanılan silinmenin bir parçasıdır. 70 kg ağırlığındaki bir insan vücudundaki potasyum içeriği yaklaşık 160 g (4090 mmol) - %0,23'tür. Potasyum, aktif hücresel katyonların toplam sayısının 2/3'ünü oluşturan ana hücre içi katyondur. Vücutta bulunan toplam potasyum miktarının %98'i hücrelerin içinde bulunur ve sadece yaklaşık %2'si hücre dışı sıvıda bulunur. Potasyum vücutta dağılır. Topografyası: karaciğer, böbrekler, kalp, kemik dokusu, kaslar, kan, beyin vb. K iyonları fizyolojik süreçlerde önemli bir rol oynar - kas kasılması, kalbin normal çalışması, sinir uyarılarının iletilmesi, metabolik reaksiyonlar. K iyonları, hücre içinde bulunan enzimlerin önemli aktivatörleridir. 38. IIA-grubunun s-elementlerinin biyolojik rolü. Tıpta kullanımları (berilyum, magnezyum, kalsiyum) Berilyum, bitkilerde olduğu kadar hayvan organizmalarında da bulunur. Berilyumun canlı organizmalardaki içeriği% 107'dir, yani. bir safsızlık ultramikro elementidir. Berilyumun biyolojik rolü yeterince araştırılmamıştır. Berilyum bileşikleri toksiktir ve bir takım hastalıklara (berilyum raşitizmi, berilyoz vb.) neden olur. Berilyumun uçucu bileşikleri özellikle toksiktir. Be2+'nın fizyolojik süreçler üzerindeki olumsuz etkisi, kimyasal özellikleri ile açıklanmaktadır. Magnezyum resmi olarak bir makrobesindir. Vücuttaki toplam içeriği %0,027'dir (yaklaşık 20 g). Magnezyumun insan vücudundaki topografyası şu şekildedir: magnezyum büyük ölçüde dentin ve diş minesi, kemik dokusunda yoğunlaşmıştır. Ayrıca pankreas, iskelet kasları, böbrekler, beyin, karaciğer ve kalpte birikir. Bir yetişkinde günlük magnezyum ihtiyacı yaklaşık 0,7 g'dır Mg iyonu, K iyonu gibi hücre içi bir katyondur. Vücudun biyolojik sıvılarında ve dokularında magnezyum hem su iyonu formunda hem de proteine bağlı halde < 10 miktarında bulunur.2%, yani özünde bir mikro elementtir. Hücrelerdeki Mg iyonlarının konsantrasyonu, hücre dışı sıvılardakinden yaklaşık 2,5-3 kat daha yüksektir. Magnezyum iyonları insan vücudunda önemli bir biyolojik rol oynar. Daha küçük iyon yarıçapı ve Mg'nin daha yüksek iyonlaşma enerjisi nedeniyle2+ Ca iyonundan daha güçlü bağlar oluşturur ve bu nedenle enzimatik işlemler için daha aktif bir katalizördür. Çeşitli enzimatik sistemlerin bir parçası olan Mg iyonu, bunların vazgeçilmez bileşeni ve aktivatörüdür (karboksipeptidaz, kolinesteraz ve diğerleri gibi enzimler Mg iyonuna özgüdür). Bir dizi enzimatik reaksiyonla ilişkili ATP'nin hidrolizi, bunun sonucunda hidrofosfasyon HPO2 oluşur ve büyük miktarda enerji açığa çıkar, fazla Mg ile gerçekleşir.2+. Kalsiyum bir makro besindir. Vücuttaki toplam içeriği %1,4'tür. Kalsiyum insan vücudunun her hücresinde bulunur. Kalsiyumun büyük kısmı kemik ve diş dokularında bulunur. Kalsiyum ihtiyacı sadece 1 g olmasına rağmen, bir yetişkin günde ortalama 0,5 g kalsiyum tüketmelidir. Nispeten zayıf emilim, gastrointestinal kanalda az çözünür kalsiyum fosfat Ca oluşumunun bir sonucudur.3(PO4)2 ve yağ asitlerinin kalsiyum tuzları. Vücutta Ca iyonlarının konsantrasyonu hormonlar tarafından düzenlenir. Bir yetişkinin kemiklerinde ve dişlerinde yaklaşık 1 kg kalsiyum, çözünmeyen kristalimsi bir mineral olan hidroksiapatit Ca formundadır.10(RO4)6(OH)2 oluşumu Ca iyonlarının fosfatlama ile etkileşimi sırasında meydana gelir. Kanda ve lenfte, kalsiyum hem iyonize hem de iyonize olmayan bir halde bulunur - proteinler, karbonhidratlar vb. Ca iyonları sinir uyarılarının iletilmesinde, kas kasılmasında, kalp kasının düzenlenmesinde rol oynar. Hücre içindeki ve dışındaki Ca iyonlarının konsantrasyonu sırasıyla 10'dur.6 ve (2,25-2,8) 103 mol/l. Kalsiyum pratik olarak hücre içinde kullanılmadığından, vücutta - kemiklerde, dişlerde - bir yapı malzemesi görevi görür. İskelet, vücudun ana kalsiyum deposudur. 39. VIB-grubunun d-elementlerinin biyolojik rolü. Tıpta kullanımları Krom, bitki ve hayvan organizmalarında bulunur. Bir yetişkinin vücudu yaklaşık 6 g Cr (%0,1) içerir. Krom metali toksik değildir, Cr(III) ve Cr(VI) bileşikleri ise sağlığa zararlıdır. Deri tahrişine neden olarak dermatite yol açarlar. Krom (VI) türevlerinin kanserojen özelliklere sahip olduğu varsayımı vardır. 0,25-0,3 g potasyum dikromat ölüme neden olur. Krom (VI) bileşikleri fungisit olarak kullanılır (dekapaj maddeleri, mantar - "mantar", kaldere - "öldür"). Krom (III) bileşikleri, bitki büyümesi üzerinde faydalı bir etkiye sahiptir. Molibden, en önemli biyoelementlerden biri olan "yaşam metallerine" aittir. Özel konumu 20-25 yıl önce F. Krin ve L. Oril tarafından belirtilmiştir. Bu bilim adamları, Dünya'da yaşamın ortaya çıkışının evrimle değil, bilinmeyen bir uygarlık tarafından uzaydan, yaşamın bizden çok önce var olduğu molibden yıldızlarından getirildiği fikrini ileri sürmüşlerdir. Biyokimyasal süreçlerde, molibden VI ve VI oksidasyon durumlarında yer alır. Bu hallerde kararlı okso formları oluşturur. Molibden, kararlı okso kompleksleri oluşturur ve görünüşe göre, okso gruplarının transferini sağlayan enzimlerin bir parçasıdır. Mo (VI) kanda baskındır; ligand oksijen ise, kararlı izopolimolibdasyonlar oluşur. Gıdalardaki aşırı molibden içeriği Ca metabolizmasını bozar2+ ve RO4 , kemik gücünde azalmaya neden olur - osteoporoz. Belki de fosfomolibden komplekslerine bağlanma meydana gelir. Bu tür kompleksler, heteropolimolibdik asitlerin asit kalıntıları olarak düşünülebilir. Kalsiyum ile bu kalıntılar çözünmeyen kristaller oluşturur. Bu kristallerin ürik asit tuzlarının birikmesini başlatması ve gut hastalığına neden olması mümkündür. Gut, eklemleri deforme ederek gerçek çevirisini haklı çıkarır - "ayak tuzağı". Oksijen komplekslerine ek olarak molibden, halojenür (Hal), tiyosiyanat (NCS) ve siyanür (CN) kompleksleri oluşturur. Molibden, çeşitli enzimlerin bir bileşenidir. İnsan vücudunda bunlara aldehit hidroksidazlar, ksantin dehidrojenazlar ve ksantin oksidazlar dahildir. Ksantin oksidazın (COX) moleküler ağırlığı 250 a.u. e. m. Bu, memelilerin molibden içeren bir enzimidir. Aldehitlerin yanı sıra ksantin ve diğer pürinlerin oksidasyonunu katalize edebilir. Hipoksantin ve ksantinin ürik aside dönüşümü, ksantin oksidaz tarafından katalize edilir. Katalitik işlem sırasında molibdenin, ksantinin nitrojen ve oksijeni ile bir bağ oluşturduğu varsayılmaktadır. Molibden, bitkilerin en önemli mikro elementidir, çünkü katılımıyla biyolojik olarak aktif maddeler hafif azot fiksasyonu sağlar: onu amonyak veya azot içeren ürünlere dönüştürürler. Diğer endüstriyel olarak önemli metallerle karşılaştırıldığında, molibden düşük toksisiteye sahiptir. Gıda ile molibden tüketimi 0,1 - 0,3 mg / gün'dür, ancak gerekli günlük alım belirlenmemiştir. Molibden eksikliği dokularda ksantin oksidaz aktivitesinde azalmaya neden olur. Aşırı molibden içeriği osteoporoza neden olur. Tungsten bir eser elementtir. Vücuttaki rolü iyi anlaşılmamıştır. Tungstenin anyonik formu, gastrointestinal kanalda kolayca emilir. Metal tungsten ve katyonik formları vücutta emilmez. Memelilerde tungsten homeostazı hakkında bilgi yoktur. 40. Manganez bileşiklerinin biyolojik rolü. Tıpta kullanımları VIIB grubunun elementlerinden sadece manganez biyojenik bir elementtir ve canlı organizmalarda normal süreç akışı için gerekli olan on "yaşam metalinden" biridir. Bir yetişkinin vücudu 12 mg içerir. Manganez kemiklerde (% 43), geri kalanında - beyin dahil yumuşak dokularda yoğunlaşmıştır. Vücutta manganez, proteinler, nükleik asitler, ATP, ADP, bireysel amino asitlerle metal kompleksleri oluşturur. Manganez metalloenzimler arginaz, kolinesteraz, fosfoglukomutaz, piruvat karboksilaz içerir. Memelilerin vücudundaki amino asitlerin dönüşümünün toksik bir ürünü olan amonyağın bağlanması, amino asit arginin aracılığıyla gerçekleştirilir. Arginaz, karaciğerde argininin hidrolizini katalize eden bir enzimdir. Sonuç olarak, arginin üreye ve siklik amino asit ornitine parçalanır. Üre toksik olmayan, suda çözünür bir maddedir. Kan dolaşımı ile böbreklere taşınır ve idrarla atılır. Manganezin atom yarıçapı 128 pm'dir. Bu, manganezin ATP ile kombinasyonunda magnezyumun (atomik yarıçap 160 pm) yerini alabileceği ve vücuttaki enerji transferini önemli ölçüde etkilediği gerçeğini açıklar. Mg ve Mn iyonları ayrıca enzimlerin - nükleazların aktivasyonunu gerçekleştirir. Bu enzimler, duodenumda DNA ve RNA nükleik asitlerinin hidrolizini katalize eder. Sonuç olarak, bu biyopolimerler monomerik birimlere - nükleotitlere ayrılır. Özellikle böyle bir nükleaz, yalnızca Mg varlığında DNA hidrolizini katalize eden deoksiribonükleazdır.2+ veya Mn2+. Manganez ayrıca vücuttaki inorganik bileşiklerin bir parçası olabilir. Bu, örneğin, az çözünür bir manganez magnezyum pirofosfat MnMgP'dir.2O7. Bu tuzun kristalleri vezikül zarının iç yüzeyinde lokalizedir. Manganez ve demirin atom yarıçapının hemen hemen aynı değeri, manganezin eritrosit porfirin kompleksindeki demirin yerini alma yeteneğini açıklar. Aynı nedenden dolayı, manganez çinkoya bağımlı enzimlerde çinkonun yerini alabilir, böylece katalitik özelliklerini değiştirebilir. Potasyum permanganat KMnO4 - tıpta kullanılan en ünlü manganez bileşiği. KMnO içeren sulu çözeltiler kullanın4 %0,01-5. Hemostatik ajan olarak %5'lik bir solüsyon kullanılır. Potasyum permanganat çözeltileri, yüksek oksitleyici gücü ile belirlenen antiseptik özelliklere sahiptir. Diğer manganez bileşiklerinden, anemi tedavisinde kullanılan manganez (II) sülfat ve manganez (II) klorür not edilmelidir. Teknesyumun canlı organizmalarda varlığına dair veri yoktur. Bununla birlikte, radyoizotop tanı yöntemi için bifosfonatlı teknesyum bileşikleri kullanılır. 41. Demir bileşiklerinin biyolojik rolü. Hemoglobin Demir, hayvanların ve bitkilerin dokularında bulunan biyojenik bir elementtir. Bir yetişkinin vücudundaki toplam demir kütlesi yaklaşık olarak 5 g'dır ve bu da %0,007'dir. Metalik demir düşük toksiktir ve büyük miktarlarda Fe (II), Fe (III) ve Fe (VI) bileşikleri sağlığa zararlıdır. Miyoglobin, sitokromlar, katalaz hücresel solunumu sağlar. Tüm bu proteinler, kendi protein kısımlarından ve bunlarla ilişkili aktif merkezlerden oluşur. Aktif merkez, makrosiklik karmaşık bir bileşiktir - heme. Bileşik porfirin, makrosiklik bir ligand görevi görür. Verici nitrojen atomları, merkezinde bir Fe iyonu bulunan bir karenin köşelerinde bulunur. Genel olarak, kompleks bir oktahedral konfigürasyona sahiptir. Amino asidin (histidin) nitrojeni yoluyla beşinci yörünge, hemi proteine bağlamak için kullanılır. Hemoglobin, tek bir makromoleküler agrega oluşturan 4 protein molekülünden (alt birimden) oluşur. Her alt birim yapı olarak miyoglobin molekülüne benzer. Böylece, hemoglobin aynı anda dört O molekülünü bağlayabilir.2 ve miyoglobin - 1. Dokularda hem olmayan demir içeren protein kompleksleri de vardır. Bunlar, örneğin enzimler - oksidazlar ve ayrıca proteinler - depolama (depo) ve demir taşıyıcılarıdır. Fazla demir, protein transferrin tarafından kana taşınır ve başta karaciğer, dalak ve kemik iliği olmak üzere çeşitli doku ve organlarda ferritin proteini şeklinde birikir. Ferritin, 24-12 nm çapında bir küre oluşturan 14 protein molekülünden (alt birimden) oluşur. Her alt birim, 7'e kadar demir atomu içeren 4500 nm çapında bir boşluk içerir. Böylece, her ferritin agregası yaklaşık 100 demir atomu depolayabilir ve bu elementi içeren çok sayıda metabolik reaksiyon sağlar. Kimyasal denge yasalarına dayanarak, hemoglobinin akciğerlerden dokulara oksijen taşıyıcısı olarak işleyişini anlamak zor değildir. Oksijensiz hemoglobin (deoksihemoglobin) zayıf bir asittir ve kimyasal formülü HHb olarak gösterilebilir.+. Oksijen ilavesine bir protonun eliminasyonu eşlik eder ve oksihemoglobin HbO oluşur.2 . Bu durumda, bir denge vardır: HHb+ + O2 → HbO2 + K+. Oksijenden fakir venöz kan, oksijenin kısmi basıncının yüksek olduğu (20 kPa'ya kadar) akciğerlere girdiğinde, Henry yasasına göre çözünürlüğü artar. Bu, Le Chatelier ilkesine uygun olarak, dengenin sağa kaymasına ve oksihemoglobin oluşumuna yol açar. Sağa ek bir denge kayması, akciğerlerde pH değerinin artmasından (7,5'e kadar) kaynaklanmaktadır. Sonuç olarak, akciğerlerde deoksihemoglobin neredeyse tamamen (%97'ye kadar) oksijenle doyurulur ve oksihemoglobine geçer. Periferik dokulara nüfuz eden kılcal damarlarda, kısmi oksijen basıncı 5 kPa'ya, pH değeri 7,2'ye düşer. Sonuç olarak, denge sola kayar. Periferden akan kanda hemoglobin oksijenle sadece %65 oranında doyurulur. 42. Demir bileşiklerinin biyolojik rolü. CO karbon monoksit. Hem içeren proteinlerin metal kompleksi özellikleri, CO (karbon monoksit) ve MCN (siyanürler - hidrosiyanik asit tuzları) gibi toksik maddelerin etkisi altında kendini gösterir. Fizyolojik açıdan en önemlileri demir içeren proteinlerdir: hemoglobin, miyoglobin, sitokromlar, peroksidazlar, katalaz. Kırmızı kan hücrelerinin ana bileşeni olan hemoglobin, akciğerlerden dokulara oksijen taşıyıcısı olarak dış solunum sağlar. Demir Fe ve kobalt Co, canlı organizmaların temel eser elementleridir. Karbon monoksit CO, yakıtın eksik yanması ürünlerinden biridir. Bu gazın önemli miktarları kazanların, içten yanmalı motorların çalışması ve sigara içme sırasında yayılır. CO, oksihemoglobin HbO ile paralel olarak akciğerlerde hava ile solunduğunda2 bir metal kompleksi bileşiği oluşur - karbonil hemoglobin HbCO. HbCO'nun kararlılık sabiti, HbO'nun yaklaşık 200 katıdır.2 . Bu nedenle, az miktarda CO bile önemli bir oranda deoksihemoglobini "keser", sonuç olarak organlara oksijen tedariki azalır. Hipoksi belirtileri var - oksijen eksikliği. İlk etkilenen sinir dokusudur. Karbon monoksiti detoksifiye etmek (toksik etkisini ortadan kaldırmak) için çoğu durumda arzını durdurmak ve oksijen havalandırmasını artırmak - kurbanı temiz havaya çıkarmak yeterlidir. Bu durumda, Le Chatelier'in prensibi tekrar çalışır - denge oksihemoglobin oluşumuna doğru kayar. Yüksek konsantrasyonlarda karbon monoksit, hücresel solunumun hem içeren proteinlerini bloke eder ve ölümcül bir sonuçtan kaçınmak zordur. Siyanürlerin etki mekanizması benzerdir, ancak toksisiteleri CO'nunkinden daha yüksektir. Bu maddelerin çok küçük miktarlarının bile kana geçmesi solunum durmasına ve ölüme yol açar. Siyanürlerin yüksek toksisitesi, siyanür hemoglobininin daha yüksek stabilitesini belirleyen Fe-CN- bağının yüksek gücü ile açıklanır. Oksijen solunumu, hidrojen peroksit H oluşumuna yol açar.2O2 . Bu madde yüksek oksitleme gücüne sahiptir. Hücrelerin biyoorganik bileşikleriyle etkileşime girdiğinde, radikaller oluşur - doymamış değerlikli çok aktif moleküler parçacıklar ve peroksit oksidasyonu başlatılır. Radikallerin etkisi altında, hücrenin en önemli bileşenleri - zarlar ve DNA - yok edilir. Biyolojik evrim sürecinde, doğa özel bir protein geliştirmiştir - hidrojen peroksidi yok eden katalaz enzimi. Bu, bu maddenin aşırı birikimini sınırlar ve hücrenin yok edilmesini önler. Katalaz eylemi (CatFe2+ ) iki ardışık reaksiyonun katalitik döngüsü olarak temsil edilebilir: kedi kafesi2+ + K2O2 - Kedi Fe2+ × H2O2 , kedi kafesi2+ × H2O2 + K2O2 → Kedi Fe2+ + 2Н2O2 + O2 . Sonuç olarak 2 molekül hidrojen peroksit yok edilir ve CatFe2+ biyokatalizör molekülü salınır ve bir sonraki katalitik döngüye girebilir. Bu süreç çok hızlıdır. Bir saniye içinde 1 katalaz molekülü 20 döngüye kadar gerçekleştirebilir. 43. Demir ve kobalt bileşiklerinin biyolojik rolü Vücutta demir eksikliği ile bir hastalık gelişebilir - demir eksikliği anemisi (anemi). Hemoglobin sentezi için demir eksikliği ile ilişkili doku oksijen eksikliği vardır. Sonuç olarak, periferik organlara oksijen verilmesi azalır ve buna bağlı olarak hücresel solunum seviyesi azalır ve metabolizma yavaşlar. Demir (II) klorür veya demir (II) sülfatın ilaç olarak kullanılması hastalığın şiddetini azaltır. Aynı amaçlar için, mide suyunun hidroklorik asidinde kolayca çözünen ince bir metalik demir tozu (doz başına 1 g'a kadar indirgenmiş demir) kullanılır. Bu nedenle, bu ilacın etkisi, demir klorürün (II) etkisine benzer. Bununla birlikte, şekerler, nikotinamid ve diğer organik maddelerle demirin biyoinorganik kompleksleri olan ilaçlar daha etkilidir. Bu tür kompleksler, farmakolojik etkinliklerinin nedeni olan kana iyi emilir. Antik çağlardan günümüze, sözde demir şarabının demir eksikliği anemisini tedavi etmek için kullanıldığını not etmek ilginçtir - demir talaşlarına üzüm şarabı demlenerek elde edilen bir içecek. Açıkçası, demir şarapta (asidik ortamda) çözünür ve içinde büyük miktarlarda bulunan doğal organik maddelerle kompleksler oluşturur. Eski içeceğin etki mekanizmasının modern ilaçlarla yaklaşık olarak aynı olduğu açıktır. Demir gibi kobalt da en önemli biyojenik elementlerden biridir. Bir yetişkinin vücudundaki toplam kobalt kütlesi yaklaşık olarak 1,2 mg'dır ve bu %10'dan azdır. Bu kütlenin yaklaşık 100 mg'ı siyanokobalamin (yağda çözünen B vitamini) formundadır.12 ) ve analogları. Bu madde, heme gibi, makrosiklik kompleks bir bileşiktir. Dört dişli bir bileşik olan porfin, bir makrosiklik ligand görevi görür. R, karmaşık bir organik ikame edicidir. Siyanokobalamin analoglarında, CN anyonu yerine çeşitli organik sübstitüentler etki eder. B vitamininin en önemli rolü12 kırmızı kan hücrelerinin (eritropoez) gelişiminde ve oluşumunda rol oynar. B vitamini eksikliği12 (günde 3 mcg'den az alım) ciddi bir hastalığa yol açar - pernisiyöz anemi (anemi). Siyanokobalamin analoglarının aktivatörler - eritropoezde yer alan çeşitli enzimlerin kofaktörleri olduğu tespit edilmiştir. Kofaktörlerin eksikliği, hemoglobin ve eritrosit eksikliğinde kendini gösterir. Bitkiler ve hayvanlar B vitamini sentezleyemezler.12. Sadece belirli bakteri türleri tarafından üretilir. Bu bakteriler insan gastrointestinal sisteminde bulunur. Yeterince B vitamini sentezlerler.12. Pernisiyöz anemi, bu vitaminin kana emiliminin bozulmasıyla ilişkilidir. Bu nedenle, hap almak etkisizdir. Kana bir vitamin enjeksiyonu (100 gün boyunca 200-2 mcg) hastanın malign anemisi olan durumunu önemli ölçüde iyileştirir. 44. IB-grubunun d-elemanlarının rolü. Bileşiklerinin tıpta kullanımı Bakır Cu, canlı organizmaların temel bir mikro elementidir. Gümüş Ag ve altın Au saf olmayan eser elementlerdir. Bileşikleri tıpta kullanılır. Bakır, hayvan ve bitki dokularında bulunan biyojenik bir elementtir. Bir yetişkinin vücudundaki toplam bakır kütlesi yaklaşık olarak 100 mg'dır, bu da yaklaşık %0,0001'dir. Bu miktarın yaklaşık %30'u kaslarda bulunur. Karaciğer ve beyin de bakır açısından zengindir. Metalik bakır ve bileşikleri zehirlidir. Fizyolojik açıdan en önemlileri bakır içeren proteinlerdir - sitokrom oksidaz ve süperoksit dismutaz. Sitokrom oksidaz, mitokondriyal zarlarda lokalize olan solunum zincirinin bileşenlerinden biridir. Solunum zincirinin sonunda oksijeni suya indirgeyerek hücresel solunumu sağlar. Vücudun günlük 2,5-5,0 mg bakıra ihtiyacı vardır. Vücutta bakır eksikliği ile bir hastalık gelişebilir - bakır eksikliği anemisi. Bakır, demirin emilmesi için, özellikle hem demir hem de bakır içeren sitokrom oksidaz sentezinde gereklidir. Bakır eksikliği ile bağ dokularının ve kan damarlarının normal gelişimi bozulur. Zehirlenme genellikle kazara aşırı dozda böcek ilacı, metal tozunun solunması, bakır tuzu çözeltilerinin yutulması ile ilişkilidir. Bakır kaplarda saklanan ve duvarların koruyucu kaplaması olmayan içecekler büyük tehlike arz etmektedir. Harici bir ajan olarak,% 0,25'lik bir sulu bakır sülfat CuSO çözeltisi kullanılır.4 mukoza zarının iltihabı ve konjonktivit ile. Anemide eritropoezi artırmak için bu ilacın küçük dozları yiyeceklerle birlikte alınabilir. Gümüş ve altın Bir yetişkinin vücudunda yaklaşık 1 mg gümüş, yani yaklaşık %10 (milyonda 1 parça) ve 10 mg'a kadar altın, yani yaklaşık %10 (milyonda 10 parça) bulunur. Çözünebilir gümüş tuzlarının antiseptik özellikleri eski zamanlardan beri bilinmektedir. Rahipler, gümüş kaplarda saklandığında suyun ("kutsal") uzun süre bozulmadığını, yani mikrobiyal kirlenmeye maruz kalmadığını uzun zamandır biliyorlardı. Şu anda, "gümüş" suyun bu özelliği denizciler tarafından uzun mesafeli yolculuklarda kullanılmaktadır. 7 g AgNO yutulduğunda bir yetişkinde güçlü toksik belirtiler gözlenir.3. Tıpta, kristal gümüş nitrat AgNO03 (lapis) ve sulu çözeltileri gibi ilaçlar uzun süredir kullanılmaktadır. Metalik parlaklığa sahip ince tozlar olan kolloidal metalik gümüş müstahzarları protargol (%8 Ag) ve yakagol (%70 Ag) uzun zamandır bilinmektedir. Bu tür tozların her bir parçacığı, bir protein kabuğu albümin (protargol) veya kollajen (collargol) ile boyut olarak 1 um'den daha küçük bir indirgenmiş metalik gümüş kristalidir. Protein kabuğu, gümüş kristallerin birbirine yapışmasını önler ve sulu ortama geçişlerini sağlar (çözünür). Gümüş müstahzarları, anti-inflamatuar, antiseptik ve büzücü ajanlar olarak kullanılır. Altın müstahzarları da etkili anti-inflamatuar ilaçlar olarak kullanılır. En bilinenleri %30 asil metal içeren krizanol ve kolloidal altındır. 45. Grup IIB'nin d-elementlerinin biyolojik rolü. Bileşiklerinin tıpta kullanımı Çinko Zn, kadmiyum Cd, cıva Hg eser elementlerdir. Bir yetişkinin vücudu 1,8 g Zn, 50 mg Cd, 13 mg Hg içerir. Kadmiyum ve cıva saf olmayan elementlerdir. Cıvanın yaklaşık %70'i yağ ve kas dokularında yoğunlaşmıştır. Kadmiyum böbreklerde% 30, geri kalanı karaciğerde, akciğerlerde, pankreasta lokalizedir. Çinko, tüm bitkiler ve hayvanlar için gerekli bir elementtir. Bir yetişkinin vücudunda çinkonun çoğu kaslarda (%65) ve kemiklerde (%20) bulunur. Miktarın geri kalanı kan plazması, karaciğer, eritrositler üzerine düşer. Prostat bezindeki en yüksek çinko konsantrasyonu. Çinko değişken değerlik göstermez. Görünüşe göre, bu nedenle, biyokompleksleri, elektron transferi olmadan meydana gelen birçok biyokimyasal hidroliz reaksiyonunda yer alır. Zn iyonu, esterlerin ve proteinlerin hidrolizini katalize eden 40'tan fazla metalloenzimin bir parçasıdır. En çok çalışılanlardan biri biyoinorganik çinko kompleksidir - yaklaşık 30 amino asit kalıntısından oluşan karbonik anhidraz enzimi (Mg = 000). Çinko, dipeptitlerin (2 amino asitten oluşan maddeler) hidrolizini katalize eden dipeptidaz enzimlerinin bir parçası değildir. Çinko, kan şekerini düzenleyen bir hormon olan insülin ile biyo-inorganik bir kompleks oluşturur. İnsanın çinko ihtiyacı gıda ürünleri ile tamamen karşılanır: et, süt, yumurta. Bitkilerde çinko eksikliği ile protein ve karbonhidrat metabolizması bozulur, klorofil ve vitaminlerin sentezi engellenir. Çinko içeren gübreler kullanılarak çinko eksikliği giderilir. Grup IIB bileşiklerinin toksisitesi çinkodan cıvaya doğru artar. Suda çözünen bileşikler cildi tahriş eder ve yutulması halinde zehirlenmeye neden olur. Metallerin kendileri de zehirlidir - çinko buharı (çinko üretiminin havası) solunduğunda, bir "metal" ateşi ortaya çıkar. Orta Çağ'da cıva buharı zehirlenmesi "çılgın şapkacı hastalığı" olarak adlandırılıyordu. Yiyeceklerdeki cıva içeriği (Japonya'da olduğu gibi denizde) minomata hastalığına yol açar. Cıva toksisitesi, eritrositlerin aglütinasyonu (birbirine yapışması), enzimlerin inhibisyonu ile ilişkilidir. Örneğin süblimasyon, kılcal damarlardan hareket etmeleri için gerekli olan kırmızı kan hücrelerinin boyutunda bir değişikliğe, ozmotik kırılganlığa ve deforme olabilirliğinde bir azalmaya neden olur. Kadmiyumun toksisitesi, nükleik asitlere olan afinitesi ile ilgilidir. DNA'ya bağlanması sonucunda işleyişi bozulur. Kronik kadmiyum ve cıva toksisitesi kemik mineralizasyonunu bozabilir. Toksik elementler kalsiyumun yerini alabilir. Bu, kemik dokusunun kristalli bileşeninin parametrelerinin bozulması nedeniyle kusurlu bir yapıya sahip apatit oluşumuna yol açar. Sonuç olarak, kemik gücü azalır. 46. IIB (Zn, Cd, Hg) grubuna ait bileşiklerin toksik özellikleri Zn, Cd, Hg bileşikleri, böbrekler yoluyla plazma proteinlerinin salınmasında (proteinüride) kendini gösteren protein metabolizmasının ihlaline neden olabilir. Grup IIB bileşiklerinin vücut üzerindeki toksik etkisi, bu metal iyonlarının proteinlerin, enzimlerin ve amino asitlerin sülfidril SH gruplarıyla etkileşime girmesinden de kaynaklanmaktadır. Metal iyonları SH grupları ile etkileşime girdiğinde, zayıf ayrışan ve kural olarak çözünmeyen bileşikler oluşur. Bu nedenle, sülfhidril gruplarının bloke edilmesi, enzim aktivitesinin ve protein katlanmasının baskılanmasına yol açar. Divalent metal iyonları aynı anda iki SH grubunu bloke eder. Bu tür reaksiyonlarda metal iyonları alıcı, kükürt ise elektron verici görevi görür. Cıvadaki SH grupları için en belirgin kimyasal afinite. Açıkçası, bunun nedeni cıvanın kompleks oluşturma özelliklerinin daha yüksek olması ve kükürt ile daha güçlü bağlar oluşturmasıdır. SH grupları, bu grupların bloke edilmesi nedeniyle aktivitesi baskılanabilen 100'den fazla enzimin parçasıdır. Bu nedenle, vücudu metallerle zehirlemek için engelleme mekanizmasını ve tedavi yöntemlerini bilmenin ne kadar önemli olduğu açıktır. Elementlerin toksik özelliklerinin vücuda girdikleri kimyasal forma bağlı olduğu bilinmektedir. En toksik formlar, lipitlerde çözünen ve zardan hücreye kolayca nüfuz eden formlardır. Literatür, Japonya'da bir toplu cıva zehirlenmesi vakasını tanımlamaktadır. İnorganik cıva bileşikleri, mikrobiyal enzimlerin etkisi altında metil cıvaya dönüştürüldü. Balıklarda biriken metil cıva daha sonra gıda ile insan vücuduna girer. Yavaş yavaş yoğunlaşan metil cıva, vücutta geri dönüşü olmayan tahribata ve ölüme neden olur. Çinko ve cıva bileşiklerinin tıpta kullanımı, büzücü, dağlayıcı ve antiseptik etkilerine dayanmaktadır. Göz damlası olarak, % 0,25 sulu çinko sülfat ZnSO çözeltisi kullanılır.4. Diş hekimliğinde, iltihaplı mukoza zarlarını tedavi etmek için papillomları koterize etmek için çinko klorür kullanılır. Çinko oksit ZnO da kullanılır. Cıva (II) klorür (cıva klorür) çok zehirlidir ve dezenfeksiyon için yüksek seyreltmelerde (1: 1000) sulu çözeltileri kullanılır. Deri ve cinsel yolla bulaşan hastalıkların tedavisi için cıva oksit (II) HgO ve cıva sülfür (II) HgS içeren merhemler kullanılır. Cıva(I) klorür (kalomel) suda az çözünür ve bu nedenle hafif toksiktir. Bu tuz veteriner hekimlikte müshil olarak kullanılır. Normal koşullar altında cıva, diğer metalleri çözebilen sıvı bir metaldir. Bu durumda sert alaşımlar - amalgamlar - oluşur. Diş hekimliğinde, gümüş ve kadmiyum amalgamları uzun süredir dişleri doldurmak için kullanılmaktadır. Kimyasal olarak inerttirler, ısıtıldıklarında kolayca yumuşarlar ve bu nedenle kolayca şekillendirilirler. Ultraviyole ışık kaynakları - tıbbi amaçlı cıva-kuvars lambaları - gaz halinde cıva (buharlar) içerir. Hastane odalarında bu lambalardan çıkan ışıkla ışınlandığında havada bulunan mikroorganizmalar yok edilir. Ultraviyole ışınlarının yardımıyla çeşitli cilt hastalıkları tedavi edilir. Böylece, işleyişin ve vücut üzerindeki etkisinin doğasına göre, IIB grubunun metalleri, hayati element Zn ve toksik safsızlık elementleri Cd ve Hg'ye ayrılabilir. 47. Grup IIIA'nın p-elementlerinin biyolojik rolü. Bileşiklerinin tıpta kullanımı Bor saf olmayan bir eser elementtir, insan vücudundaki kütle oranı %105'tir. Bor esas olarak akciğerlerde (0,34 mg), tiroid bezinde (0,30 mg), dalakta (0,26 mg), karaciğerde, beyinde (0,22 mg), böbreklerde, kalp kasında (0,21 mg) yoğunlaşır. Borun biyolojik etkisi henüz yeterince çalışılmamıştır. Bor, dişlerde ve kemiklerde, görünüşe göre metal katyonları ile az çözünen borik asit tuzları formunda olduğu bilinmektedir. Fazla bor insan vücuduna zararlıdır. Bor fazlalığının amilazları, proteinazları inhibe ettiğine ve adrenalin aktivitesini azalttığına dair kanıtlar vardır. İnsan vücudundaki içeriğe göre (%105), alüminyum safsızlık mikro elementlerine aittir. Alüminyum esas olarak kan serumunda, akciğerlerde, karaciğerde, kemiklerde, böbreklerde, tırnaklarda, saçta yoğunlaşır, insan beyninin sinir kılıflarının yapısına girer. Bir insan tarafından günlük alüminyum alımı 47 mg'dır. Alüminyum, epitel ve bağ dokularının gelişimini etkiler, kemik dokusunun yenilenmesini, fosfor değişimini etkiler. Alüminyumun enzimatik süreçler üzerinde etkisi vardır. Vücuttaki fazla alüminyum, hemoglobin sentezini engeller, çünkü oldukça yüksek kompleks oluşturma kabiliyeti nedeniyle alüminyum, hematopoezde yer alan aktif enzim merkezlerini bloke eder. Alüminyumun transaminasyon reaksiyonunu katalize edebileceğine dair kanıtlar vardır. Galyum bir safsızlık eser elementtir (insan vücudundaki içerik 10-6-10-5%). Galyumun canlı organizmalardaki biyolojik rolü neredeyse net değildir. Talyum oldukça zehirli bir elementtir. T1 iyonu, Ag+ gibi, kükürt içeren ligandlarla güçlü bileşikler oluşturma eğilimindedir. Sonuç olarak, tiyo grupları - SH içeren enzimlerin aktivitesini inhibe ettiği için çok toksiktir. Çok küçük miktarlarda bile T1+ bileşikleri yutulduğunda saç dökülmesine neden olur. K yarıçapının yakınlığı nedeniyle+ ve T1+ benzer özelliklere sahiptirler ve enzimlerde birbirlerinin yerini alabilirler. İyonlar T1 ve K sinerjistlerdir. Bu, piruvat kinaz ve diol dehidrataz enzimlerinin sadece K iyonları tarafından değil, aynı zamanda T1 iyonları tarafından da aktive edildiğini açıklar (T1 iyonu, enzimlerin katalitik merkezinde K iyonunun yerini alır). Talyum ve potasyumun sinerjisi, K iyonları gibi T1 iyonlarının da eritrositlerde birikmesiyle kendini gösterir. T1 iyonları ile zehirlenme için bir panzehir olarak, kükürt içeren bir ligand olan amino asit sistin kullanılır. Sonuç olarak, grup IIIA p-elementlerinin biyolojik rolünün yeterince araştırılmadığına dikkat edilmelidir. Bor ve galyumun bitkilerde polifenoller, gelişimlerinin inhibitörleri ile etkileşime girdiği ve ikincisinin toksisitesini azalttığı artık bilinmektedir. Alüminyumun epitel ve bağ dokularının yapımında şüphesiz rolü ve ayrıca hem aktivatör hem de inhibitör olarak enzimatik işlemlere katılımı da kurulmuştur. T1 iyonu, kükürt içeren birçok enzimi inhibe etme yeteneğine sahiptir. Grup IIIA elementlerinin biyolojik aktivitesi, temel olarak oksijen içeren ligandlar ve çözünmeyen fosfatlarla kompleks bileşikler oluşturma yetenekleriyle ilgilidir. 48. IVA grubunun p-elementlerinin biyolojik rolü. Bileşiklerinin tıpta kullanımı İnsan vücudundaki içeriğe göre (%21,15), karbon makro besinlere aittir. Proteinler, yağlar, karbonhidratlar, vitaminler, hormonlar şeklinde tüm doku ve hücrelerin bir parçasıdır. Biyolojik açıdan karbon, 1 numaralı organojendir. İnsan vücudundaki içeriğe göre (%103 ־), silikon safsızlık mikro elementlerine aittir. Çoğu silikon karaciğerde, adrenal bezlerde, saçta, lenste. Doğal silikon dioksit suda az çözünür olduğundan, insan vücuduna sindirim sistemi yoluyla değil, tozlu SiO şeklinde akciğerler yoluyla hava yoluyla girer.2. Silikon metabolizmasının ihlali ile hipertansiyon, romatizma, ülser, anemi oluşumu ilişkilidir. Tıbbi uygulamada silikon karbür (IV) SiC kullanılır - dolguların ve plastik protezlerin taşlanması için carborundum. silikon dioksit SiO2 silikat çimentolarının bir parçası. Sistematik olarak akciğerlere maruz kaldığında kömür, silikon dioksit ve alüminyum parçacıklarından oluşan tozun bir hastalığa - pnömokonyoza neden olduğuna dikkat edilmelidir. Kömür tozunun etkisi altında, madencilerin meslek hastalığı olan antrakozdur. S1O içeren tozun solunması2 , alüminyum tozu - alüminoz etkisi altında silikoz oluşur. İnsan vücudundaki içeriğe göre (10-6-10-5%) germanyum bir mikro elementtir. Biyolojik rolü tam olarak aydınlatılamamıştır. Germanyum bileşikleri, kemik iliğinde hematopoez süreçlerini geliştirir. Germanyum bileşiklerinin düşük toksisiteye sahip olduğu da bilinmektedir. İnsan vücudundaki içeriğe göre (104 %) kalay, eser elementleri ifade eder. Kalay, insan vücuduna, bir kalay tabakasıyla kaplanmış teneke kutularda saklanan asitli yiyeceklerle girer. Asidik bir ortamda kalay çözünür ve kana tuz şeklinde girerek toksik etki gösterir. Bununla birlikte, sıçanlar üzerinde yapılan deneylerde, küçük miktarlardaki kalayın sıçanların büyümesi üzerinde uyarıcı bir etkiye sahip olduğu bulunmuştur. Bu, insanlar için gerekliliğini varsaymak için sebep verir. Kuşkusuz, bu mikro elementin biyolojik rolünün aydınlatılması daha fazla çalışmayı gerektirir. Tıbbi uygulamada, başta kalay içeren dolgu malzemeleri olmak üzere çeşitli malzemeler kullanılmaktadır. Bu nedenle kalay, dolgu üretimi için gümüş amalgamın (%28) bir parçasıdır. Kurşun ve bileşikleri, özellikle organik olanlar oldukça zehirlidir. Kurşun bileşikleri protein sentezini, hücre enerji dengesini ve genetik aparatını etkiler. Birçok faktör, bir denatürasyon mekanizması lehine konuşur. Gıdalarda bulunması çürük gelişimini etkileyen elementlerden birinin kurşun olduğu tespit edilmiştir. Yiyecek, su, atmosferik hava ile bir kişi günde 100 mikrograma kadar kurşun emer. Kurşun esas olarak iskelette (%90'a kadar) idareli çözünür fosfat formunda birikir. Kurşunun insan vücudundaki kütle oranı %106־'dir. Günlük 0,2-2 mg kurşun alımının insanlar için güvenli olduğu kabul edilir. Tıbbi uygulamada, kurşun asetat (losyonlar) ve kurşun oksit (II) PbO (basit kurşun yamasının bir parçası), harici büzücü antiseptikler olarak uygulama bulmuştur. 49. VA grubunun p-elementlerinin biyolojik rolü. Bileşiklerinin tıpta kullanımı (azot, fosfor) İnsan vücudundaki nitrojen içeriği (%3,1) makrobesinleri ifade eder. Sadece vücudun kuru madde kütlesini (susuz) hesaba katarsak, hücrelerdeki nitrojen içeriği% 8-10'dur. Bu element amino asitlerin, proteinlerin, vitaminlerin, hormonların ayrılmaz bir parçasıdır. Azot, biyomoleküllerde hidrojen ve karbon atomları ile kutupsal bağlar oluşturur. Birçok biyoinorganik komplekste (metaloenzimler), nitrojen atomları, verici-alıcı mekanizma ile molekülün inorganik ve organik kısımlarını bağlar. Oksijen ve karbon ile birlikte nitrojen hayati bileşikler oluşturur - hem temel özelliklere sahip bir amino grubu hem de asidik özelliklere sahip bir karboksil grubu (-COOH) içeren amino asitler. Amino grubu da nükleik asit moleküllerinde çok önemli bir işlevi yerine getirir. Nitrojen içeren biyoligandların - hemoglobin gibi porfirinlerin - fizyolojik önemi çok büyüktür. Azot döngüsü biyosferde gerçekleşir. Azot döngüsü tarım için hayati öneme sahiptir. Azotun biyolojik olarak önemli bir özelliğine daha dikkat etmek gerekir - sudaki çözünürlüğü oksijeninkiyle hemen hemen aynıdır. Kanda aşırı nitrojen bulunması, dekompresyon hastalığının gelişmesinin nedeni olabilir. Dalgıçların hızla yükselmesiyle, basınçta keskin bir düşüş meydana gelir, buna göre kandaki nitrojenin çözünürlüğü azalır (Henry yasası) ve kandan çıkan elementer nitrojen kabarcıkları küçük damarları tıkar, bu da felce ve ölüme yol açabilir. İnsan vücudundaki içeriğine göre (%0,95), fosfor makro besinler grubuna aittir. Fosfor bir organojen elementtir ve metabolizmada son derece önemli bir rol oynar. Fosfat formundaki fosfor, hücre içi ATP'nin temel bir bileşenidir. Proteinlerin (%0,5-0,6), nükleik asitlerin, nükleotitlerin ve diğer biyolojik olarak aktif bileşiklerin bir parçasıdır. Fosfor, hayvan ve insan iskeletinin (kalsiyum ortofosfat, hidroksilapatit), dişlerin (hidroksiapatit, florapatit) temelidir. Fosfat gruplarının yüksek enerjili bir alıcıdan düşük enerjili bir alıcıya aktarılması nedeniyle birçok biyosentetik reaksiyon gerçekleştirilir. Fosfat tampon sistemi, kandaki ana tampon sistemlerinden biridir. Canlı organizmalar fosfor olmadan yapamazlar. Fosforun önemi, şekerlerin ve yağ asitlerinin önceden fosforilasyon olmaksızın hücreler tarafından enerji kaynağı olarak kullanılamaması gerçeğinde yatmaktadır. Vücuttaki fosfor değişimi, kalsiyum değişimi ile yakından ilgilidir. Bu, kandaki kalsiyum içeriğinde bir artış (antagonizma) ile inorganik fosfor miktarındaki bir azalma ile doğrulanır. Günlük insan fosfor ihtiyacı 1,3 g'dır Fosfor, gıda ürünlerinde o kadar yaygındır ki, görünür eksikliği (fosfat açlığı) vakaları pratikte bilinmemektedir. Bununla birlikte, gıda ürünlerinde bulunan fosforun tamamı emilemez, çünkü emilimi birçok faktöre bağlıdır: pH, gıdadaki kalsiyum ve fosfor oranı, gıdadaki yağ asitlerinin varlığı, ancak her şeyden önce vitamin içeriği. D. İlaç olarak bir dizi fosfor bileşiği kullanılmaktadır. C-P bağını içeren organofosfor bileşiklerinin güçlü sinir zehirleri olduğu ve kimyasal savaş ajanlarının bir parçası olduğu unutulmamalıdır. 50. VA grubunun (arsenik, antimon, bizmut) p-elementlerinin biyolojik rolü. Tıpta kullanımları İnsan vücudundaki içeriğe göre arsenik eser elementlere aittir. Karaciğer, böbrekler, dalak, akciğerler, kemikler, saçta yoğunlaşır. Arseniğin çoğu beyin dokusunda ve kaslarda bulunur. Arsenik kemiklerde ve saçta birikir ve birkaç yıl boyunca onlardan tamamen atılmaz. Bu özellik, arsenik bileşikleri ile zehirlenme olup olmadığı sorusunu netleştirmek için adli muayenede kullanılmaktadır. Biyolojik malzemede arsenik tayini, Marsh reaksiyonuna göre basit bir cihazda gerçekleştirilir: biyolojik nesneye çinko ve hidroklorik asit eklenir. Reaksiyon sırasında salınan hidrojen, herhangi bir arsenik bileşiğini arsine indirger. Serbest kalan hidrojen bir arsin karışımı içeriyorsa, gaz karışımı ısıtıldığında AsH ayrışır.3 : 2Kül3 = 2As° + 3H2. ve gaz oluşumu için tüpün duvarlarında siyah parlak bir arsenik kaplaması oluşur - bir "arsenik aynası". Marsh reaksiyonu çok hassastır ve 7-10 tanesini tespit edebilir.7 g arsenik. Nispeten büyük dozlarda arsenik bileşikleri çok zehirlidir. Daha önce bahsedildiği gibi, arsenik bileşiklerinin toksik etkisi, sülfhidril enzim gruplarının ve diğer biyolojik olarak aktif maddelerin bloke edilmesinden kaynaklanmaktadır. İnsan vücudundaki içeriğine göre (%10) antimon ve bizmut mikro elementlerdir. V. V. Kovalsky'nin sınıflandırmasına göre, antimon ve bizmut, canlı organizmalarda sürekli bulunan, ancak fizyolojik ve biyokimyasal rolü pratikte net olmayan mikro elementler grubuna aittir. Antimonun fizyolojik rolü açıkça arsenik ile benzerdir. Arsenik As ve antimon Sb iyonları ve daha az ölçüde bizmut Bi sinerjisttir. Bu nedenle, organizmalarda fazla arsenik bulunan biyojeokimyasal illerde, sadece arsenik içeriğinin değil, aynı zamanda antimon içeriğinin de arttığı bilinmektedir. Aynı zamanda, her iki element de sakinlerin tiroid bezinde birikir, işlevini engeller ve endemik guatra neden olur. Arsenik ve antimonun sinerjisi, kükürt içeren ligandlarla bileşikler oluşturma yetenekleriyle ilişkilidir. Bizmut, amino grupları içeren ligandlarla bağlanmaya daha yatkındır. Böylece, çözünür bizmut bileşiklerinin vücuda girişi, amino ve karboksipolipeptidaz enzimlerinin inhibisyonuna yol açar. Stibin SbH3 gibi suda çözünür antimon bileşiklerinin yutulması, arsenik bileşiklerine benzer toksik bir etkiye sahiptir. Bizmut bileşikleri de enjekte edildiğinde toksiktir. Örneğin köpekler için öldürücü doz 6 mg/kg vücut ağırlığıdır. Bununla birlikte, çoğu antimon ve bizmut bileşiği sindirim sistemine girdiğinde, pratik olarak toksik bir etkisi yoktur. Bu bileşiklerin zayıf toksisitesi, sindirim sistemindeki Sb (III), Bi (III) tuzlarının, gastrointestinal sistemin duvarlarına emilmeyen zayıf çözünür ürünlerin oluşumu ile hidrolize maruz kalmasından kaynaklanmaktadır. Bu, antimon ve bizmut ilaçlarının, örneğin bazik bizmut nitratın kullanımının temelidir. 51. VIA-grubunun p-elementlerinin biyolojik rolü. Bileşiklerinin tıpta kullanımı İnsan vücudundaki içeriğe göre (%62), oksijen makro besinlere aittir. Vazgeçilmezdir ve canlı sistemlerin temelini oluşturan en önemli unsurlardan biridir, yani bir organojendir. Oksijen, en basitinden biyopolimerlere kadar çok sayıda molekülün bir parçasıdır. Oksijenin yaşam süreçlerindeki rolü büyüktür, çünkü besinlerin (karbonhidratlar, proteinler, yağlar) oksijenle oksidasyonu, canlı organizmaların organ ve dokularının işleyişi için gerekli bir enerji kaynağı görevi görür. Vücuttaki çoğu redoks reaksiyonu, oksijenin ve aktif formlarının katılımıyla ilerler. Vücudun fagositik (koruyucu) işlevleri de oksijenin varlığı ile ilişkilidir ve vücuttaki oksijen içeriğinin azalması koruyucu özelliklerini azaltır. Fagositlerde (yabancı cisimleri yakalayıp sindirebilen hücreler), oksijen 02 süperokside indirgenir. Tıbbi uygulamada oksijen, oksijen eksikliği (hipoksi), solunum yolu hastalıkları, kardiyovasküler sistem, karbon monoksit (II) CO, hidrosiyanik asit HCN ile zehirlenme ve ayrıca solunum fonksiyonlarında bozulma olan hastalıkların eşlik ettiği ağrılı koşullarda inhalasyon için kullanılır. . Klinik uygulamada yaygın olarak kullanılan hiperbarik oksijenasyondur - yüksek basınç altında oksijen kullanımı. Oksijen - ozon O3'ün çok güçlü bir oksitleyici ajan olarak allotropik modifikasyonu, binaların dezenfeksiyonu, hava dezenfeksiyonu ve içme suyunun arıtılması için kullanılır. İnsan vücudundaki içeriğine göre (%0,16), kükürt makrobesinlere aittir. Oksijen gibi hayati önem taşır. Bir yetişkinin günlük kükürt ihtiyacı yaklaşık 4-5 g'dır Kükürt birçok biyomolekülün bir parçasıdır - proteinler, amino asitler (sistin, sistein, metiyonin vb.), Hormonlar (insülin), vitaminler (B1 vitamini). Saç karoteninde, kemiklerde, sinir dokusunda çok fazla kükürt bulunur. Canlı organizmalarda amino asitlerin bir parçası olan kükürt oksitlenir. Bu işlemin son ürünleri ağırlıklı olarak sülfatlardır. Ayrıca tiyosülfatlar, çimento kükürt ve politiyonik asitler oluşur. Vücuttaki içeriğe göre (10-5-10-7%) selenyum bir mikro elementtir. Bazı araştırmacılar bunun hayati bir unsur olduğunu düşünüyor. Selenyum yiyeceklerden gelir - yılda 55-110 mg. Selenyum esas olarak karaciğer ve böbreklerde yoğunlaşmıştır. Kandaki selenyum konsantrasyonu 0,001-0,004 mmol / l'dir. Selenyumun canlı organizmalarda kükürt ile bağlantısı şüphesizdir. Yüksek dozlarda selenyum öncelikle kükürt içeren amino asitlere dayanan tırnaklarda ve saçta birikir. Selenyumun vücudu cıva Hg ve kadmiyum Cd ile zehirlenmeden koruma yeteneği de bilinmektedir. Selenyum, bu toksik metallerin toksik etkilerinden etkilenmeyen diğer aktif merkezlere bağlanmasını teşvik eder. İlginç bir gerçek, diyetteki yüksek selenyum içeriği ile kanserden düşük ölüm oranı arasındaki ilişkidir. Selenyum yüksek dozlarda zehirlidir. Hayvanlarda selenyum bileşiklerinin parçalanması, sarımsak kokusuna sahip oldukça toksik dimetil selenyumun salınmasına yol açar. 52. VIIA grubunun p-elementlerinin biyolojik rolü. Bileşiklerinin tıpta kullanımı (flor ve klor) İnsan vücudundaki içeriğine göre klor (%0,15) makro elementlere aitken, bu grubun geri kalan elementleri mikro elementlerdir (içerik - 105 %). Çeşitli bileşikler şeklindeki halojenler, insan ve hayvanların dokularının bir parçasıdır. Klor ve iyot yeri doldurulamaz elementlerdir, geri kalanı ise dokuların kalıcı bileşenleridir. İnsan vücudundaki flor kütlesi yaklaşık 7 mg'dır (~105 %). Flor bileşikleri kemik dokusunda, tırnaklarda, dişlerde yoğunlaşmıştır. Dişlerin bileşimi yaklaşık %0,01 flor içerir ve çoğu, içinde az çözünür florapatit varlığı ile ilişkili olan mine üzerine düşer. Vücutta florür eksikliği diş çürüklerine yol açar. Florun biyolojik etkisine olan ilgi, öncelikle diş hastalıkları sorunuyla ilişkilidir, çünkü flor dişleri çürükten korur. Diş dokularının (dentin) mineral temeli hidroksiapatit, klorapatit ve florapatittir. Çoğu zaman, bir emaye tabakası ile kaplanmış dişin dış yüzeyi değil, tahribata maruz kalır, ancak emaye hasar gördüğünde dentinin iç kısımları açığa çıkar. Mine hafif hasarlıyken, sodyum florürün eklenmesinin florapatit oluşumunu teşvik ettiği ve başlayan hasarın remineralizasyonunu kolaylaştırdığı yönünde öneriler vardır. Sodyum florür NaF, tıbbi uygulamada topikal bir harici ajan olarak kullanılır. NaF kullanımı, fluorapatit oluşumuna dayanmaktadır. Aynı zamanda, bakteriler tarafından üretilen asitlerin nötralizasyonuna katkıda bulunan ağız boşluğu ortamının alkalinizasyonu da meydana gelir. Sadece flor eksikliği değil, fazlalığı da zararlıdır. İçme suyundaki flor içeriği izin verilen maksimum oranın (1,2 mg/l) üzerinde olduğunda, diş minesi kırılgan hale gelir, kolayca yok edilir ve diğer kronik flor zehirlenmesi semptomları ortaya çıkar - artan kemik kırılganlığı, kemik deformasyonları ve vücudun genel yorgunluğu . Bu durumda ortaya çıkan hastalığa florozis (florozis) denir. İnsan vücudu yaklaşık 100 g (2790 mmol) klor içerir. Kloridler önemli bir biyolojik rol oynar. Bazı enzimleri aktive ederler, mide suyunun protolitik enzimlerinin etkisi için uygun bir ortam yaratırlar, hücre zarlarından iyon akışı sağlarlar ve ozmotik dengenin korunmasına katılırlar. Kloridyon, hücre zarından penetrasyon için optimal bir yarıçapa sahiptir. Bu, belirli bir ozmotik basıncın yaratılmasında ve su-tuz metabolizmasının düzenlenmesinde Na ve K iyonlarıyla ortak katılımını açıklar. Günlük sodyum klorür ihtiyacı 5-10 g'dır.Daha önce tartışıldığı gibi, midede hidroklorik asit üretimi için NaCl gereklidir. Hidroklorik asidin sindirim sürecindeki önemli rolüne ek olarak, çeşitli patojenik bakterileri (kolera, tifo) yok eder. Bakteriler mideye çok miktarda su ile girerse, HCl'nin seyreltilmesi nedeniyle antibakteriyel etkisi yoktur ve bakteriler hayatta kalır. Bu da vücutta hastalığa yol açar. Bu nedenle, salgınlar sırasında ham su özellikle tehlikelidir. Midede yetersiz miktarda hidroklorik asit ile pH yükselir ve insan sağlığını ciddi şekilde etkileyen normal sindirim bozulur. Mide suyunun asitliği azaltıldığında, tıbbi uygulamada seyreltik bir hidroklorik asit çözeltisi kullanılır. Mide iltihabı (gastrit), peptik ülser ile mide suyunun salgılanması artar, asitliği artar. 53. VIIA grubunun p-elementlerinin biyolojik rolü. Bileşiklerinin tıpta kullanımı (brom, iyot) İnsan vücudundaki brom kütlesi yaklaşık 7 mg'dır. Esas olarak endokrin bezlerinde, öncelikle hipofiz bezinde lokalizedir. Brom bileşiklerinin vücudun normal işleyişindeki biyolojik rolü henüz yeterince aydınlatılamamıştır. Brom bileşikleri tiroid bezinin işlevini engeller ve adrenal korteksin aktivitesini arttırır. Bromidler vücuda verildiğinde, merkezi sinir sistemi en hassas olanıdır. Bromidyonlar beynin çeşitli bölgelerinde eşit olarak birikir ve artan uyarılabilirlik ile sakinleştirici hareket eder. Uyarma ve engelleme süreçleri arasındaki bozulan dengenin yeniden kurulmasına katkıda bulunurlar. Bromidyonlar gastrointestinal kanalda kolayca emilir. Bromidyonların toksisitesi düşüktür. Vücuttan yavaş atılması nedeniyle (30-60 gün içinde), birikebilirler (birikebilir), bu da bromizm adı verilen kronik zehirlenmenin gelişmesine yol açar. Kronik brom zehirlenmesi belirtileri ortaya çıkarsa, bromür preparatları derhal kesilmelidir. Ek olarak, bromidyonların salınım hızını artırmak için (Le Chatelier prensibi) büyük miktarda sodyum klorür verilir (günde 25 g'a kadar) ve bol miktarda içecek reçete edilir. Farklı bireysel hassasiyetler nedeniyle, brom preparatlarının dozu 0,05 ila 2,0 g arasında değişir. İyot temel biyojenik elementlerden biridir ve bileşikleri metabolik süreçlerde önemli bir rol oynar. İyot, belirli proteinlerin, yağların, hormonların sentezini etkiler. İnsan vücudu yaklaşık 25 mg iyot içerir. Vücuttaki toplam iyot miktarının yarısından fazlası tiroid bezindedir. Bu bezde bulunan iyotun hemen hemen tamamı bağlı durumdadır (hormon formunda) ve sadece yaklaşık %1'i iyodiyon formundadır. Tiroid bezi, plazmadaki içeriğine kıyasla I-25 kez konsantre olabilir. Tiroid bezi tiroksin ve triiyodotironin hormonlarını salgılar. Yetersiz aktif bir tiroid bezi (hipotiroidizm), iyodür iyonlarını biriktirme kabiliyetinde bir azalma ve ayrıca diyette iyot eksikliği (endemik guatr) ile ilişkili olabilir. Endemik guatr ile iyot preparatları reçete edilir: (potasyum iyodür KI veya sodyum iyodür NaI) günlük insan iyot ihtiyacına (0,001 g potasyum iyodür) karşılık gelen dozlarda. İyot eksikliği olan bölgelerde endemik guatrın önlenmesi için sofra tuzuna NaI veya K eklenir! (1 kg'da 2,5-100 gr). Tiroid bezinin artan aktivitesi ile (hipertiroidizm), tiroid hormonlarının aşırı sentezi nedeniyle anormal derecede artan metabolik süreç hızı gözlenir. Bu ilaçların hipertiroidizmin tedavisi için etkisizliği ile, radyasyonu tiroid bezinin foliküllerini tahrip eden ve böylece hormonların aşırı sentezini azaltan bir radyoaktif iyot 131 I preparatı kullanılır. VIIA grubunun tüm elementleri fizyolojik olarak aktiftir ve organizmanın hayati aktivitesi için klor ve iyot vazgeçilmezdir. Flor, canlı organizmaların normal işleyişi için gerekli bir element olarak kabul edilir. Vücutta halojenler birbirinin yerine kullanılabilir, hem sinerji hem de antagonizma gözlemlenir. 54. Aerosoller Aerosoller, gazlı bir dağılım ortamına sahip dağılmış sistemlerdir. Dağılmış fazın toplanma durumuna bağlı olarak, sisler ayırt edilir - sıvı dağılmış faza sahip aerosoller; duman, toz - katı dağılmış faza sahip aerosoller; sis - karışık dağılmış faza sahip aerosoller. Aerosollerin dağılmış fazının partikül boyutları, dağılmış sistemlerin sınıflandırmasına göre 10 ile XNUMX arasında değişmektedir.7 10 için9 m Diğer dispers sistemler gibi, aerosoller de iki yöntemle elde edilir: yoğuşma ve dispersiyon. yoğunlaşma yöntemi Dağınık faz, buhar fazından, moleküllerin kolloidal büyüklükteki partiküllere yoğunlaştırılmasının fiziksel süreci ile elde edilir. Dispersiyon yöntemleri Kolloidal büyüklükteki parçacıklar, daha büyük agregaların öğütülmesiyle elde edilir. Aerosoller ışığı dağıtma özelliğine sahiptir. Aerosollerin dağılmış fazının parçacıkları çift elektrik katmanına sahip değildir, ancak dağılmış fazın parçacıkları çok sıklıkla bir elektrik yükü taşır. Yük, sürtünmenin bir sonucu olarak veya gaz iyonlarının adsorpsiyonu nedeniyle ortaya çıkar. Çoğu zaman aerosol parçacıklarının (küçük ve büyük) zıt işaretli bir yük taşıdığına dikkat edilmelidir. Parçacıkların yükseklik boyunca büyük hacimli aerosollerde boyutlarına göre ayrılması, yüksek yoğunluklu bir elektrik alanının ortaya çıkmasına neden olabilir. Böylece bulutlarda bir elektrik boşalması meydana gelir - şimşek. Aerosoller, faz sınırında çift elektrik katmanı olmadığından kinetik ve toplu olarak kararsız sistemlerdir. Bu nedenle, aerosoller liyosollerden daha hızlı pıhtılaşır. Tıpta, aerosoller inhalasyon tedavisinde, hasarlı cildi korumak, dezenfeksiyon için kullanılır. Bazen aerosol oluşumu son derece istenmeyen bir durumdur. Dökümhanelerde, seramik endüstrilerinde, çeşitli minerallerin (cevher, kömür, asbest vb.) çıkarılması ve işlenmesi sırasında insan sağlığına zararlı aerosoller oluşmaktadır. Kömür parçacıkları içeren aerosoller akciğer hastalığına - antrakoza, silikon (IV) oksit - silikoza, asbest - asbestoza neden olur. Alerjik hastalıklara bitki poleninin oluşturduğu aerosoller, pamuk, keten, kenevir vb. işlenirken oluşan toz neden olur. Bakteri, küf ve virüs süspansiyonları - mikrobiyolojik veya bakteriyel aerosoller - bulaşıcı hastalıkların bulaşma yollarından biridir: akciğer tüberkülozu , grip, akut solunum yolu hastalıkları. Dağılmış fazı kurum, katran, kül ve kanserojen hidrokarbonlardan oluşan yakıtın yanması sırasında oluşan aerosoller insan vücuduna zararlı etkiler oluşturur. Dumanlar özellikle sağlığa zararlıdır. Bu nedenle, toz ve atmosferin kirlenmesine karşı mücadele giderek daha önemli hale geliyor. Aerosollerden havanın arıtılması, atık olmayan teknolojiler - dağılmış fazın parçacıklarını filtreler, siklonlar (santrifüjlü toz toplayıcılar) ve yüksek voltajlı bir elektrik alanı kullanarak yakalayarak sağlanır. 55. Emülsiyonlar Emülsiyonlar, dağılmış fazın ve dağılım ortamının karışmaz sıvılar olduğu mikroheterojen sistemlerdir. Dağınık fazın - sıvı damlacıkların - partikül boyutları 104 ila 106 m arasında değişir. Dağılmış fazın konsantrasyonuna bağlı olarak, emülsiyonlar ayırt edilir: seyreltilmiş, konsantre ve yüksek oranda konsantre. Dağınık fazın ve dağılım ortamının doğasına bağlı olarak, şunlar vardır: 1) polar bir sıvı (DS) içindeki polar olmayan bir sıvının (DF) emülsiyonları - birinci tür emülsiyonlar veya "yağ / su" tipi (O / W) emülsiyonları olarak adlandırılan doğrudan emülsiyonlar; 2) polar olmayan bir (DS) içindeki bir polar sıvının (DF) emülsiyonları - ikinci tür emülsiyonlar veya "su / yağ" tipi (W / O) emülsiyonlar olarak adlandırılan ters emülsiyonlar. Burada DF ve DS sırasıyla dağılmış faz ve dağılım ortamıdır, "su" herhangi bir polar sıvıdır, "yağ" polar değildir. Emülsiyon tipi ayarlanabilir: 1) elektriksel iletkenlik ölçümü; 2) aşırı polar veya polar olmayan sıvı ile karıştırma; 3) suda çözünür veya yağda çözünür boyalarla boyama; 4) hidrofobik veya hidrofilik bir yüzey üzerinde bir emülsiyon damlasının ıslatılması ve yayılmasıyla. Emülsiyonlar, diğer dispers sistemler gibi, yoğuşma ve dispersiyon yöntemleriyle elde edilir. Kaba dispersiyonlar olarak emülsiyonlar, kinetik ve toplu olarak kararsız sistemlerdir. Dağınık fazın damlacıkları çarpıştığında birleşirler (birleşme). Birleşmenin bir sonucu olarak, emülsiyon iki sürekli sıvı faza ayrılır. Emülgatörler, emülsiyonların stabilitesini arttırmak için kullanılır. Bunlar, faz sınırındaki adsorpsiyonun bir sonucu olarak, arayüz geriliminin değerini azaltan ve mekanik olarak güçlü bir adsorpsiyon filmi oluşturan yüzey aktif maddelerdir. Emülgatör bir iyonik yüzey aktif madde ise, dağılmış fazın damlacıklarına aynı işarette bir elektrik yükü verir ve damlacıklar birbirini iter. Oluşan emülsiyon tipi, emülgatörün özelliklerine bağlıdır. Dispersiyon ortamı her zaman emülgatörü en iyi çözen veya ıslatan sıvıdır. Emülgatör olarak yüksek yağ asitlerinin tuzları, yüksek yağ asitlerinin esterleri ve polihidrik alkoller, uzun zincirli aminler kullanılır. Emülsiyonlar doğada yaygın olarak bulunur. Emülsiyonlar süt, krema, ekşi krema, tereyağı, yumurta sarısı, sütlü bitki suyu, ham yağdır. Tıbbi maddeler içeren emülsiyonlar tıpta yaygın olarak kullanılmaktadır: birinci tür (O/W) dahili kullanım için, ikinci tür (W/M) harici kullanım içindir. Bitkisel ve hayvansal yağların vücut tarafından emülsifiye formda (süt) daha iyi emildiği bilinmektedir. Bu durumda, kolik ve deoksikolik asitlerin türevleri emülgatör görevi görür. Bazen ortaya çıkan emülsiyonu kırmaya ihtiyaç vardır. Bir emülsiyonun kırılmasına demülsifikasyon denir. Demülsifikasyon, sıcaklığın yükseltilmesi ve düşürülmesi, bir elektrik alanına maruz bırakılması, santrifüjleme, elektrolitler ve özel maddeler - emülsiyon önleyiciler eklenmesiyle gerçekleştirilir. Emülsiyon önleyiciler, emülsiyonlaştırıcılardan daha yüksek yüzey aktivitesine sahip yüzey aktif maddelerdir, ancak mekanik olarak güçlü bir adsorpsiyon tabakası oluşturma yeteneğine sahip değildirler. 56. Kolloidal yüzey aktif maddeler Kolloidal yüzey aktif maddeler, koşullara bağlı olarak aynı çözücü ile gerçek ve kolloidal bir çözelti oluşturan maddelerdir. Daha önce bahsedildiği gibi, sürfaktan molekülleri amfifiliktir. Kutupsuz ve kutupsal gruplardan oluşurlar. Polar olmayan radikaller, örneğin hidrokarbon zincirleri, polar çözücü - su için afiniteye sahip değildir, polar gruplar için oldukça yüksektir. Polar olmayan gruplar arasında hidrofobik (van der Waals) bir etkileşim vardır. Yaklaşık 10 zincir uzunluğunda22 hidrokarbon radikallerinin hidrofobik etkileşimleri ve polar grupların su ile güçlü etkileşimi nedeniyle karbon atomları, yüzey aktif madde molekülleri birleşir ve miseller oluşur. Bir kolloidal yüzey aktif maddenin, çözeltisinde misellerin oluştuğu minimum konsantrasyonuna kritik misel konsantrasyonu (CMC) denir. Ortaya çıkan misellerin şekli, çözeltinin konsantrasyonuna bağlıdır. Düşük kolloidal yüzey aktif madde konsantrasyonlarında küresel miseller oluşur. Bir kolloidal yüzey aktif madde çözeltisinin konsantrasyonundaki bir artış, önce sayılarında bir artışa ve ardından şekil değişikliğine yol açar. Daha yüksek konsantrasyonlarda küresel miseller yerine silindirik ve lamel miseller oluşur. CMC değeri çeşitli faktörlere bağlıdır: kolloidal yüzey aktif maddenin doğası, sıcaklık ve yabancı maddelerin, özellikle elektrolitlerin safsızlıklarının varlığı. CMC, kinetik olarak aktif parçacıkların sayısına ve boyutuna bağlı olan çözeltinin özellikleriyle, özellikle ozmotik basınç, yüzey gerilimi, elektrik iletkenliği ve optik özelliklerdeki değişikliklerle belirlenebilir. "Gerçek çözelti - kolloidal çözelti" geçişi sırasında kinetik olarak aktif parçacıkların (iyonlar, moleküller, miseller) boyutu ve sayıları değiştiğinden, "özellik - konsantrasyon" grafiğinde CMC'ye karşılık gelen bir kırılma noktası belirir. Ulusal ekonominin çeşitli sektörlerinde ve tıpta yaygın olarak kullanılmaları nedeniyle kolloidal yüzey aktif madde çözeltilerinin en önemli özelliklerinden biri çözündürmedir. Çözünme mekanizması, misellerin hidrofobik çekirdeğinde polar olmayan maddelerin çözünmesinden oluşur. Çözünme olgusu, ulusal ekonominin çeşitli sektörlerinde yaygın olarak kullanılmaktadır: gıda endüstrisinde, ilaç endüstrisinde (tıbbi maddelerin sıvı formlarını elde etmek için). "Su - fosfolipid" sisteminde, çalkalama ve karıştırma küresel miseller - lipozomlar oluşturur. Fosfolipid molekülleri, polar grupların suya baktığı ve polar olmayanların birbirine baktığı lipozomlarda iki katmanlı bir zar oluşturur. Lipozomlar, biyolojik zarların bir modeli olarak düşünülebilir. Onların yardımıyla, çeşitli bileşikler için zarların geçirgenliğini ve çeşitli faktörlerin bunun üzerindeki etkisini incelemek mümkündür. Lipozomlar, ilaçların belirli organlara veya etkilenen bölgelere hedefli olarak verilmesi için yaygın olarak kullanılmaktadır. Lipozomlar ilaçları hücrelere taşıyabilir. Lipozomal membranlar, antikorlar ve antijenler arasındaki etkileşimi incelemek için immünolojik çalışmalarda kullanılır. Yazarlar: Drozdova M.V., Drozdov
▪ Sinir hastalıkları. Ders Notları ▪ Organizasyonun Teria'sı. Beşik
Bahçelerdeki çiçekleri inceltmek için makine
02.05.2024 Gelişmiş Kızılötesi Mikroskop
02.05.2024 Böcekler için hava tuzağı
01.05.2024
▪ saha bölümü Alan gücü dedektörleri. Makale seçimi ▪ makale Üzgünüm... çünkü eğleniyorsun. Popüler ifade ▪ makale Keltler Britanya'da ne kadar yaşadılar? ayrıntılı cevap ▪ makale Orman işçilerinin iş güvenliği ▪ makale Dövülen metal dedektörü, teori. Radyo elektroniği ve elektrik mühendisliği ansiklopedisi
Ana sayfa | Kütüphane | Makaleler | Site haritası | Site incelemeleri www.diagram.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

 Diğer makalelere bakın bölüm
Diğer makalelere bakın bölüm 